我國的藥品專利鏈接要來了,仿制藥企業(yè)該如何應(yīng)對(duì)
藥品研發(fā)具有周期長、投入高、風(fēng)險(xiǎn)大的特點(diǎn),因此,需要借助相關(guān)制度的設(shè)計(jì),對(duì)藥品研發(fā)的成果予以充分保護(hù)。其中,藥品專利補(bǔ)償制度和藥品專利鏈接制度的建立就是其中重要的一項(xiàng)。
藥品專利補(bǔ)償制度:為有價(jià)值的創(chuàng)新藥品專利提供保護(hù)期延長,可鼓勵(lì)創(chuàng)新藥研發(fā)。
藥品專利鏈接制度:對(duì)創(chuàng)新藥和仿制藥提供平衡保護(hù),以鼓勵(lì)創(chuàng)新、鼓勵(lì)挑戰(zhàn)、激勵(lì)競爭。
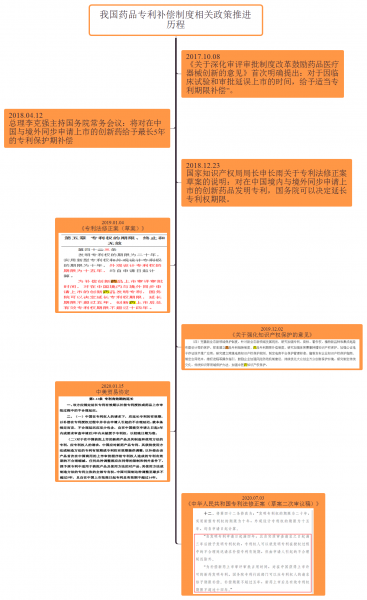
自2017年以來,中共中央、國務(wù)院及藥監(jiān)局多次發(fā)布文件,明確指出探索建立藥品專利鏈接制度和藥品專利補(bǔ)償制度。2020年7月3日,全國人大將《中華人民共和國專利法修正案(草案二次審議稿)》向社會(huì)公眾征求意見,涉及藥品專利為第十二和第二十七條款,意味著我國藥品專利補(bǔ)償制度和藥品鏈接制度即將落地。
本文通過比較研究各國相關(guān)藥品專利制度,分析我國的藥品專利補(bǔ)償制度和藥品鏈接制度的建立和實(shí)施進(jìn)展。
01專利有效期延長,利于創(chuàng)新藥企業(yè)

(1)美國最先提出“藥品專利期補(bǔ)償”的概念。1984年的Hatch-Waxman法案規(guī)定:1、美國藥品專利到期最長可延長5年,但專利補(bǔ)償期和上市后剩余的專利期累計(jì)不能超過14年;2、一種藥物只能延長一個(gè)專利的保護(hù)期。

(2)歐洲以補(bǔ)充專利證書的形式實(shí)現(xiàn)藥品專利保護(hù)期的延長(SPC)。《歐洲專利公約》(簡稱EPC)第63條規(guī)定,當(dāng)專利的客體是產(chǎn)品或產(chǎn)品制造方法、使用方法時(shí),締約國可做出延長期限或相應(yīng)保護(hù)的規(guī)定。
(3)日本的專利期延長制度主要借鑒美國,只是日本的專利補(bǔ)償制度的規(guī)定較為寬松。日本專利法第67條規(guī)定,允許藥品的多個(gè)專利多次延長,藥品上市后有效專利期不設(shè)置上限。
2017年10月《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)藥器械創(chuàng)新的意見》中首次明確提出對(duì)于因臨床試驗(yàn)和審批延誤上市時(shí)間的藥品專利給予適當(dāng)?shù)膶@谙扪a(bǔ)償。2019年1月公開的《專利法修正案(草案)》中提出對(duì)于在中國境內(nèi)和境外同步申請(qǐng)上市的創(chuàng)新藥品發(fā)明專利,國務(wù)院可以給予專利期限延長。2020年7月公開的《專利法修正案(草案二次審議稿)》中則修改為對(duì)在中國獲批上市許可的新藥發(fā)明專利適當(dāng)給予專利期限補(bǔ)償。
其中規(guī)定了兩種可以獲取專利補(bǔ)償?shù)那樾危?/p>
情形一:“自發(fā)明專利申請(qǐng)日期滿四年,且自實(shí)質(zhì)審查請(qǐng)求之日起滿三年后授予發(fā)明專利權(quán)的,專利權(quán)人可以就發(fā)明專利在侵權(quán)過程中不合理延遲請(qǐng)求補(bǔ)償專利有效期”;
情形二:“為補(bǔ)償新藥上市審評(píng)審批占用時(shí)間,對(duì)在中國獲得上市許可的新藥發(fā)明專利,國務(wù)院專利行政部門可以應(yīng)專利權(quán)人的請(qǐng)求給予期限補(bǔ)償”。
備注1:包括創(chuàng)新藥和改良型新藥
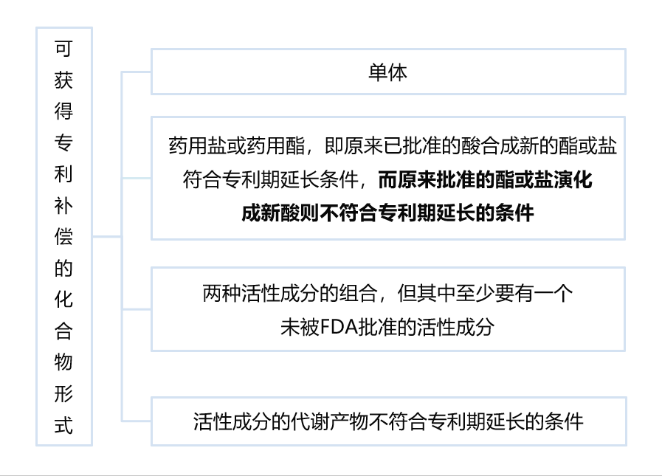
備注2:產(chǎn)品中的藥品定義為活性成分,包括物質(zhì)單體,其鹽或酯,不包括其代謝物,單獨(dú)或與其他活性成分的組合
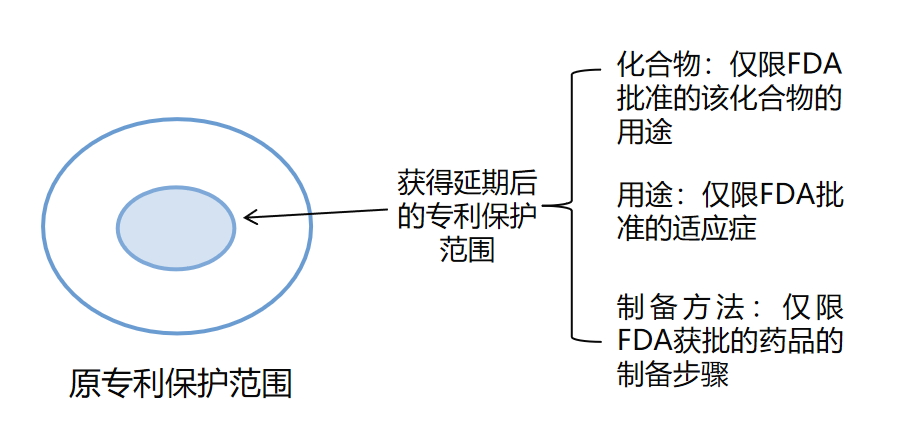
備注3:美國的藥品用途專利的保護(hù)范圍僅限于獲得FDA批準(zhǔn)的適應(yīng)癥;制備方法專利的保護(hù)范圍僅限于獲批的藥品的制備步驟,即被延長的權(quán)利要求保護(hù)范圍僅限于與FDA許可上市的藥品的有效成分,制備方法和用途相關(guān)的技術(shù)方案,而非授權(quán)權(quán)利要求保護(hù)范圍的整體。
比較分析各國專利補(bǔ)償制度的可知:
- (1)FDA批準(zhǔn)的藥品專利有效期延長后的保護(hù)范圍小于原專利要求保護(hù)的范圍,如下圖所示:
- (2)FDA對(duì)于可獲得專利期延長的藥品專利中的活性成分有特殊限定,如下所示:
- (3)日本藥品專利補(bǔ)償區(qū)別與歐美國家,同一藥品可獲得多次專利有效期補(bǔ)償
- (4)中國的藥品專利補(bǔ)償?shù)钠谙蓿ú莅付┗九c美國的一致,但尚未明確補(bǔ)償期限的計(jì)算方法及可獲得補(bǔ)償?shù)膶@愋汀V忻蕾Q(mào)易協(xié)定中則對(duì)于專利補(bǔ)償?shù)念愋徒o出明確規(guī)定:產(chǎn)品專利、方法專利及用途專利。
02專利糾紛早期解決的有效機(jī)制,藥品專利鏈接制度的建立
藥品專利鏈接,是指仿制藥上市批準(zhǔn)與創(chuàng)新藥品專利期滿相“鏈接”,即仿制藥注冊(cè)申請(qǐng)應(yīng)當(dāng)考慮先行上市藥品的專利狀況,從而避免可能產(chǎn)生專利侵權(quán)。
藥品鏈接制度最早起源于美國,1984年,美國通過Hatch-Waxman法案,該法案中規(guī)定了藥品專利鏈接制度、藥品專利保護(hù)期補(bǔ)償、數(shù)據(jù)保護(hù)等內(nèi)容。目前,加拿大、澳大利亞、韓國等國家通過與美國簽訂自由貿(mào)易協(xié)定,相繼引入了專利鏈接制度,歐盟、日本、印度尚未建立該制度。
2017年后我國開始逐步探索建立藥品專利鏈接制度,《專利法修正案(草案二次審議稿)》中明確規(guī)定了專利權(quán)人的起訴期、9個(gè)月訴訟期等內(nèi)容,其建立的基本框架與美國一致,但很多地方仍需要進(jìn)一步細(xì)化。
主要國家的藥品鏈接制度比較
備注1,美國生物類似物遵循美國的“Patent Dance”制度
備注2,原研企業(yè)在藥品獲得上市許可后30天內(nèi)提出登記申請(qǐng),藥品上市后授權(quán)的專利,在專利授權(quán)后30日內(nèi)提出申請(qǐng)。藥品獲批之后授權(quán)的專利,僅限于藥品獲得上市日之前的專利,對(duì)于在藥品獲得上市審批之以后才提交申請(qǐng)的專利,則不能列入清單中
備注3,美國藥品鏈接制度的流程圖:
由上表分析,可知我國藥品鏈接制度具有以下特點(diǎn):
- 《專利法修正案(草案二次審議稿)》中第27條第2款中規(guī)定“對(duì)技術(shù)審評(píng)通過的化學(xué)藥品上市許可申請(qǐng),國務(wù)院藥品監(jiān)督管理部門可以根據(jù)人民法院裁判或者國務(wù)院專利行政部門裁決,做出是否批準(zhǔn)藥品上市的決定”,其明確了我國的藥品鏈接制度適用的藥品種類為“化學(xué)藥品”,不包含生物制劑、中藥等,這與美國藥品鏈接制度適用的范圍一致;
- 《專利法修正案(草案二次審議稿)》中第27條第1款中規(guī)定“專利權(quán)人或者利害關(guān)系人認(rèn)為申請(qǐng)上市藥品的相關(guān)技術(shù)方案落入中國上市藥品專利信息登記平臺(tái)登載的相關(guān)專利權(quán)保護(hù)范圍的,可以自國務(wù)院藥品監(jiān)督管理部門公示藥品上市許可申請(qǐng)之日起三十日內(nèi)向人民法院提起訴訟或者向國務(wù)院專利行政部門申請(qǐng)行政裁決”。經(jīng)查詢,目前未見有“中國上市藥品專利信息登記平臺(tái)”。有收錄藥品專利信息的為“中國上市藥品目錄集”平臺(tái)。美國專利信息登記在FDA橙皮書中。
- 《專利法修正案(草案二次審議稿)》中第27條第1款中規(guī)定“專利權(quán)人或者利害關(guān)系人認(rèn)為申請(qǐng)上市藥品的相關(guān)技術(shù)方案落入中國上市藥品專利信息登記平臺(tái)登載的相關(guān)專利權(quán)保護(hù)范圍的,可以自國務(wù)院藥品監(jiān)督管理部門公示藥品上市許可申請(qǐng)之日起三十日內(nèi)向人民法院提起訴訟或者向國務(wù)院專利行政部門申請(qǐng)行政裁決”。可見,專利權(quán)人或者NDA持有人的起訴期為30日,但與美國不同的是,草案中并未規(guī)定仿制藥申請(qǐng)人主動(dòng)通知專利權(quán)人或NDA持有人的義務(wù),起訴期的起算時(shí)間點(diǎn)為自國務(wù)院藥品監(jiān)督管理部門公示藥品上市許可申請(qǐng)之日起三十日內(nèi),可見,專利權(quán)人或NDA持有人對(duì)于藥監(jiān)局公示的信息需要及時(shí)關(guān)注,才能及時(shí)發(fā)現(xiàn)潛在的侵權(quán)人;
- 《專利法修正案(草案二次審議稿)》中第27條第3款中規(guī)定“人民法院或者國務(wù)院專利行政部門自專利權(quán)人或者利害關(guān)系人請(qǐng)求受理之日起就九個(gè)月內(nèi)作出生效裁決或者行政裁決的,對(duì)技術(shù)審評(píng)通過的化學(xué)藥品上市許可申請(qǐng),國務(wù)院藥品監(jiān)督管理部門可以根據(jù)人民法院裁決或者國務(wù)院專利行政部門行政裁決,做出是否批準(zhǔn)藥品上市的決定”。美國的藥品鏈接制度規(guī)定專利權(quán)人或者利害關(guān)系人收到仿制藥申請(qǐng)人的通知后,如提起侵權(quán)訴訟,則仿制藥申請(qǐng)自動(dòng)停止審批30個(gè)月,但不會(huì)停止審批。如果30個(gè)月內(nèi),專利權(quán)人勝訴,則仿制藥申請(qǐng)人的ANDA申請(qǐng)不會(huì)獲批;仿制藥企業(yè)勝訴,F(xiàn)DA會(huì)審批上市;30個(gè)月訴訟仍未解決,F(xiàn)DA會(huì)直接批準(zhǔn)仿制藥上市。可見,與美國的鏈接制度相比,草案中規(guī)定了9個(gè)月的訴訟期,但未明確規(guī)定9個(gè)月訴訟未解決是否批準(zhǔn)藥品上市的情形。此外,9個(gè)月的時(shí)間遠(yuǎn)少于FDA規(guī)定的30個(gè)月,這也意味著專利權(quán)人不僅需要及時(shí)關(guān)注藥監(jiān)局公示的藥品上市申請(qǐng)信息及時(shí)發(fā)現(xiàn)侵權(quán)人,而且需要及時(shí)提起訴訟或請(qǐng)求行政裁決,如果9個(gè)月未有結(jié)果的話,很有可能面臨藥監(jiān)局對(duì)于仿制藥申請(qǐng)發(fā)出上市許可。此項(xiàng)條款的規(guī)定,也預(yù)示著未來國內(nèi)專利挑戰(zhàn)的案例越來越多,創(chuàng)新藥企業(yè)和仿制藥企都需要過硬的專利分析水平。
綜上,我國的藥品專利補(bǔ)償制度和鏈接制度大多借鑒了國外經(jīng)驗(yàn),相信隨著《專利法修正案(草案二次審議稿)》的公開,我國的藥品專利補(bǔ)償制度和鏈接制度會(huì)逐步實(shí)施,配套的司法規(guī)章和相關(guān)制度也會(huì)逐漸完善,最終會(huì)建立具有中國特色的有效的“銜接和鏈接”機(jī)制,進(jìn)而有效的推進(jìn)我國由制藥大國向制藥強(qiáng)國邁進(jìn)。
關(guān)于我們:
綜合信息部由20名成員組成,其中總監(jiān)1名、經(jīng)理2名、主管1名、高級(jí)藥理專員1名、藥理專員15名,均來自北京大學(xué)、中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院等國內(nèi)外知名院校。綜合信息部主要負(fù)責(zé)公司的國際/國內(nèi)項(xiàng)目立項(xiàng)、品種市場(chǎng)信息支持、公司知識(shí)產(chǎn)權(quán)維護(hù)及撰寫臨床/藥理相關(guān)申報(bào)材料,為公司研發(fā)提供信息保障。
部門下設(shè)5個(gè)中心,其中仿創(chuàng)藥立項(xiàng)策略中心主要負(fù)責(zé)仿制藥、創(chuàng)新藥品種立項(xiàng);臨床&藥理中心負(fù)責(zé)相關(guān)申報(bào)材料撰寫;知識(shí)產(chǎn)權(quán)中心負(fù)責(zé)公司知識(shí)產(chǎn)權(quán)維護(hù);大數(shù)據(jù)分析中心負(fù)責(zé)國內(nèi)外品種信息分析、企業(yè)產(chǎn)品管線規(guī)劃及戰(zhàn)略合作伙伴個(gè)性化信息支持;國際新產(chǎn)品策略中心關(guān)注國際原料藥、裝置、制劑品種信息,提供中美、中歐雙報(bào)立項(xiàng)信息。
轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
