政策法規||本周重磅政策法規概覽(21.01.04-01.08)
CDE/NMPA/CFDI/藥典委公布藥品/醫療器械相關內容本周集錦。
關于發布《化學仿制藥參比制劑目錄(第三十八批)》的公示
本批公布共計31個品規的參比制劑來源,其中新增補27個;并且9個品種未通過審議,原因主要集中于本品原研不明,且其組方臨床價值不明;存在安全性風險。

掃描圖中二維碼
查看詳細信息

NMPA
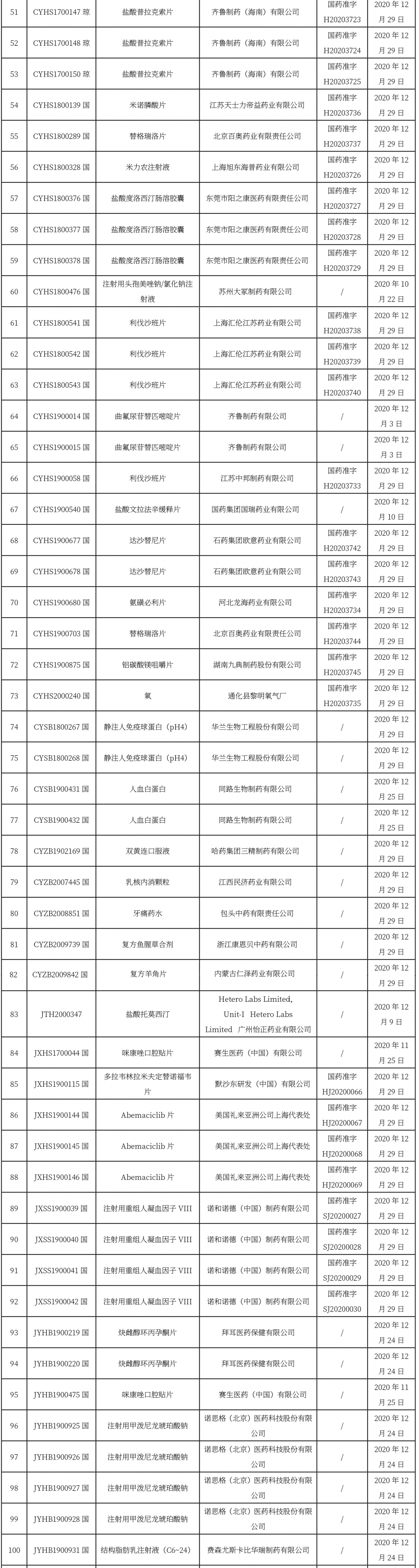
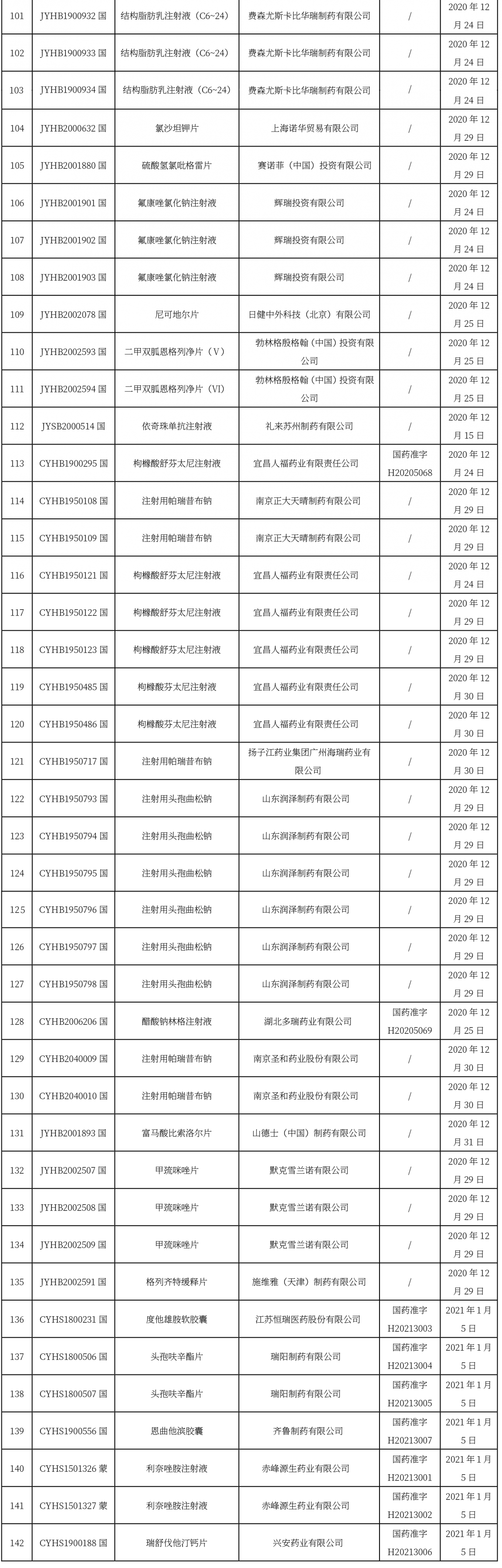
本周共計112+23+7個品種獲批取得藥品批準證明文件,其中一致性評價品種46個。

關于進一步規范醫用超聲耦合劑說明書等有關內容的公告(2020年第143號)
根據醫療器械風險評價結果,為進一步提升用械安全,消除風險隱患,國家藥監局決定進一步規范醫用超聲耦合劑產品說明書及標簽。

掃描圖中二維碼
查看詳細信息

2021年興奮劑目錄公告(第51號)
有關部門應按照國務院《反興奮劑條例》的規定,做好2021年興奮劑目錄中所列物質的生產、銷售、進出口以及反對使用興奮劑的監督管理工作。蛋白同化制劑和肽類激素的進出口管理按照《蛋白同化制劑和肽類激素的進出口管理辦法》(國家食品藥品監督管理總局 海關總署 國家體育總局令第9號)的有關規定執行。
該目錄由兩大部分組成,第一部分為興奮劑品種,第二部分為對運動員進行興奮劑檢查的有關規定。興奮劑品種主要包括七類:蛋白同化制劑品種;肽類激素品種;麻醉藥品品種;刺激劑(含精神藥品)品種;藥品類易制毒化學品品種;醫療用毒性藥品品種以及其他品種。
掃描圖中二維碼
查看詳細信息

關于金振顆粒、婦科白鳳膠囊轉換為非處方的公告(2021年第3號)
根據《處方藥與非處方藥分類管理辦法(試行)》(原國家藥品監督管理局令第10號)的規定,經國家藥品監督管理局組織論證和審定,金振顆粒、婦科白鳳膠囊由處方藥轉化為非處方藥。非處方藥說明書范本規定內容之外的說明書其他內容按原批準證明文件執行。藥品標簽涉及相關內容的,應當一并修訂。自補充申請備案之日起生產的藥品,不得繼續使用原藥品說明書。

掃描圖中二維碼
查看詳細信息

關于發布婦科調經片中金胺O檢查項補充檢驗方法等3項補充檢驗方法的公告(2020年 第151號)
根據醫療器械風險評價結果,為進一步提升用械安全,消除風險隱患,國家藥監局決定進一步規范醫用超聲耦合劑產品說明書及標簽。
掃描圖中二維碼
查看詳細信息

CFDI
本周共計112+23+7個品種獲批取得藥品批準證明文件,其中一致性評價品種46個。
藥品注冊申請藥學研制和生產現場檢查任務信息公告 (2020年第23號)
掃描圖中二維碼
查看詳細信息

藥品注冊申請藥學研制和生產現場核查任務信息公告 (2020年第24號)
掃描圖中二維碼
查看詳細信息

本周安康欣膠囊、銀屑膠囊、注射用萘普生鈉、滋陰益胃膠囊、萘普生鈉顆粒、萘普生鈉片、萘普生鈉、萘普生、補血生乳顆粒等國家藥品標準公示如下:
掃描圖中二維碼
查看詳細信息

-END-
關于我們:
藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發、注冊申報、現場核查等一體化專業技術服務為宗旨,以高效、成功申報項目最終目標。
藥政部擁有一支技術與注冊經驗豐富的團隊,作為一家提供專業服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業且豐富的經驗,已助力成功申報多項藥品注冊申請,在業內具有良好的口碑。
部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業能力、豐富注冊經驗、拓展業務范圍,致力于為客戶提供高效率、高質量、合規的技術服務,為保護和促進公眾健康而不懈努力。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
