重磅利好!千億兒童藥物市場將迎重大機遇!
目前,國內兒童藥物匱乏,兒童藥物市場長期處于兒童專用品種少、適宜劑型少、生產企業少、企業關注度高但實際研發熱度不高的局面。
由于兒童專用藥匱乏,很多患兒在服藥時都被當成“縮小版的成人”對待,按照“小兒酌減”的原則把成人藥給孩子減量使用,用藥靠掰、劑量靠猜!

“這樣做存在著巨大的安全隱患,國家藥品不良反應監測年度報告(2019年)顯示,我國14歲以下兒童患者中不良反應的報告占10.6%。兒童作為特殊用藥人群,因臟器發育尚未完全等因素的影響,對藥物更為敏感,耐受性較差,因此,兒童要用“兒童藥”!
為此,國家藥品監督管理局、衛健委、醫保局等多部委陸續出臺多項鼓勵研發兒童藥物的利好政策以推動兒童藥物的發展,2019版和2020版醫保目錄調整方案中,將兒童藥物列為優先考慮調入藥品,進一步激發企業的研發熱情。
目前已有多家企業加大對兒童藥物的研發投入,隨著與國家鼓勵政策相關的配套措施落地、資源的跟進,千億兒童用藥將迎來前所未有的發展機遇。
我國兒童人口基數龐大,根據2020年國家統計局數據顯示,2019年我國兒童人口數為2.35億人,占全國總人口的16.8%。且隨著“二胎政策”的放開,兒童人口數量將呈現明顯的上升趨勢,兒童藥物市場需求也將隨人口數量的增加而明顯擴張。
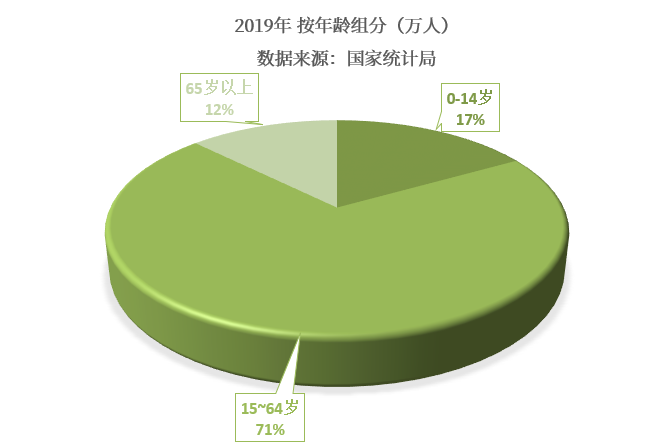
(我國兒童的概念通常是指0~14歲的人群)
02 兒科用藥市場規模高
2013年~2018年全球兒童藥物市場規模呈逐年上升趨勢,近5年復合增長率(CAGR)為3.76%,2018年全球兒童藥物市場規模約為973億美元。
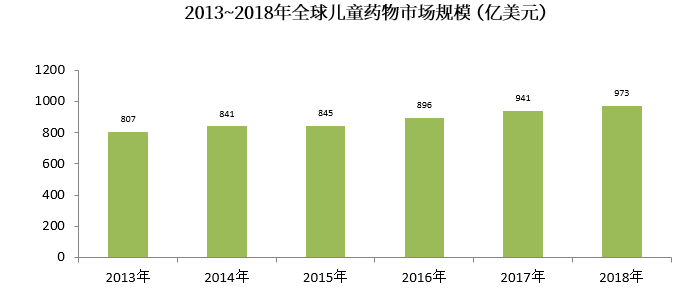
(數據來源:前瞻產業研究院公開資料)
國內市場兒童藥物規模與國際市場相匹配,2012年~2018年CAGR為+9.83%,2018年我國兒科用藥市場規模約為786.07億元,較上年同比增長11.72%,國內兒科用藥市場規模增長迅速。
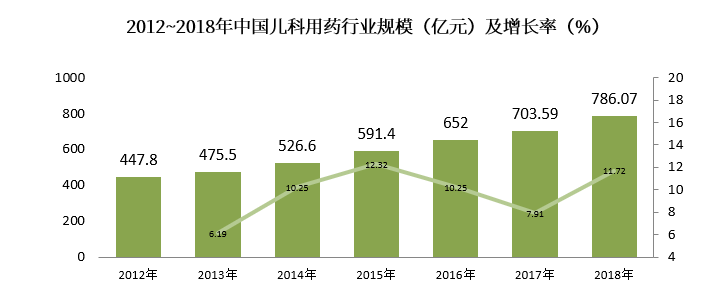
(數據來源:前瞻產業研究院公開資料)
全國工商聯藥業商會的調查顯示,國內6000多家藥廠中,專門生產兒童藥品的僅10余家,有兒童藥品生產部門的企業也僅30多家,總體企業間競爭壓力較小。目前國內重點從事兒童藥企業主要為葵花藥業、葫蘆娃藥業、康芝藥業、哈藥集團、亞寶藥業、江中藥業、華潤雙鶴、山大華特、濟川藥業、羚銳制藥、長春高新、健民集團、漢森制藥、臣功制藥等。
Insight數據庫統計顯示,截止2021年1月1日,共收錄上市批準產品(化藥、中藥和生物制劑等)批準文號數為228448個(按成分瀏覽為8487個),其中兒科專用藥物(兒童、兒科、小兒等統計)批準文號總數為3826個(成分241個);在化藥領域,總批準文號為151473(成分2195個),兒童專用藥物的總批準文號為1598(成分55個)。目前國內兒科專用產品的批準文號數量以及活性成分數量均較少,相對于全國2.2億兒童,遠遠不夠,當前我國兒童藥品短缺問題非常嚴峻,亟待補齊。

歐美國家為兒科用藥政策先行者,政策出臺鼓勵兒科用藥研發,在美國,通過兩大互補立法即《兒科研究平等法》(PREA)和《最佳兒童藥品法》(BPCA)對兒童新藥的開發、兒童臨床試驗的管理、兒童藥品的信息、兒童藥品的臨床使用等從保護兒童權益的角度進行了規定,強制性要求制藥企業對每一種可能發展為兒童用藥的新藥必須提供該藥的兒科研究數據。同時也對制藥企業進行兒童新藥開發提供了包括資金、稅收、快速評審、市場壟斷權和研究資助等諸多方面的優惠措施。
在我國,為鼓勵國內藥企加大兒童藥的研發和生產,近年來,政府部門陸續出臺了一系列相關政策,包括鼓勵研發、優先評審、加強醫院配備、招標采購直接掛網等。
此外,國家審評中心陸續發布多項兒科藥物研發指導原則,以進一步規范、指導兒童藥物研發中涉及的藥學、臨床、審評等相關工作,促進企業研發順利開展。
《關于保證兒童用藥的若干意見》印發,對保障兒童用藥提出了具體要求。
《關于成立國家衛生計生委兒童用藥專家委員會的通知》印發,完善兒童用藥數據,促進兒童用藥安全科學合理使用,保障兒童基本用藥需求,建立科學規范的兒童用藥指南。
關于征求《關于鼓勵藥品醫療器械創新保護創新者權益的相關政策(征求意見稿)》意見的公告,對批準上市既屬于創新藥又屬于罕見病用藥、兒童專用藥,給予10年數據保護期。
《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》印發,對創新藥、兒童專用藥、及挑戰專利成功藥品等給予一定的數據保護期。
李克強總理8月30日主持召開國務院常務會議決定,要求基本藥物目錄調整重點聚焦癌癥、兒科、慢性病等病種。
公布《2019年國家醫保藥品目錄調整工作方案》的公告,優先考慮國家基本藥物、癌癥及罕見病等重大疾病治療用藥、慢性病用藥、兒童用藥、急救搶救用藥等。
第十三屆全國人民代表大會常務委員會第十二次會議第二次修訂)《中華人民共和國藥品管理法》:國家采取有效措施,鼓勵兒童用藥品的研制和創新,支持開發符合兒童生理特征的兒童用藥品新品種、劑型和規格,對兒童用藥品予以優先審評審批。
《藥品注冊管理辦法》公布,將符合兒童生理特征的兒童用藥品新品種、劑型和規格的產品納入優先審評審批程序中。
《2020年國家醫保藥品目錄調整工作方案》公布,將臨床急需境外新藥名單、鼓勵仿制藥品目錄或鼓勵研發申報兒童藥品清單、且于2020年8月17日前經國家藥監部門批準上市的藥品納入2020年藥品目錄擬新增藥品范圍。
《首批鼓勵研發申報兒童藥品清單》印發。
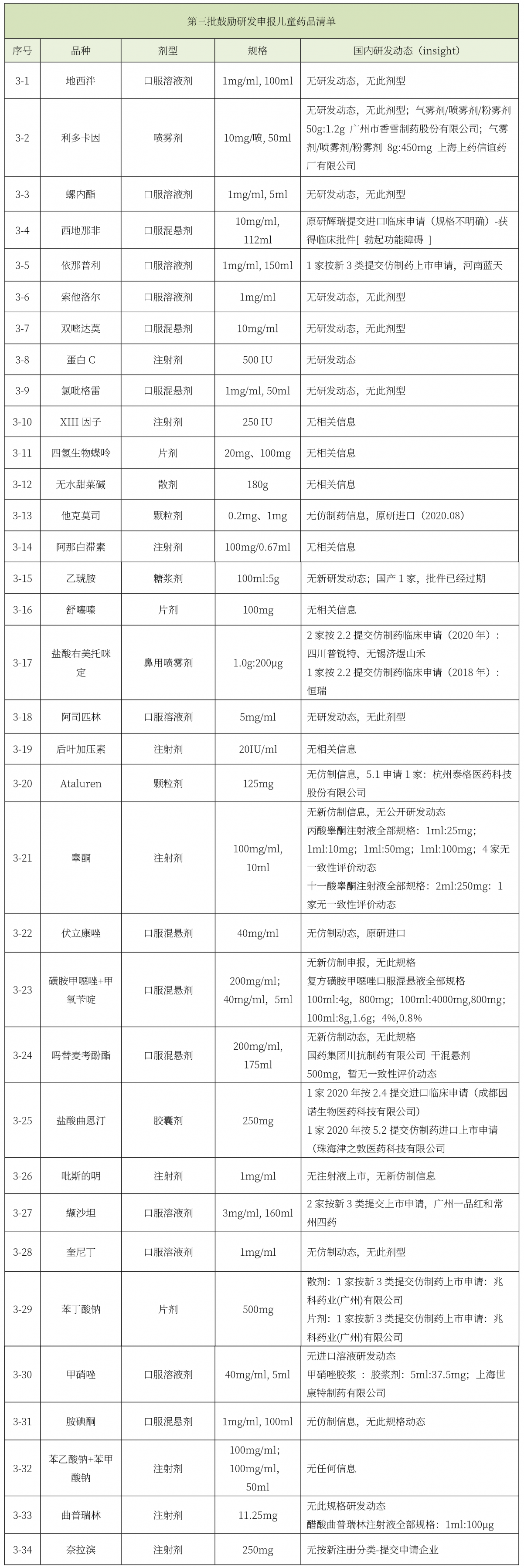
《第二批鼓勵研發申報兒童藥品清單》印發。
《第三批鼓勵研發申報兒童藥品清單》印發。
《兒科人群藥代動力學研究技術指導原則》發布,重點闡明兒科人群研究的特殊性,為計劃在兒科人群中開展藥代動力學研究的注冊申請人和科研機構提供指導性建議,鼓勵和推動針對我國兒科人群的藥物研發。
《兒科人群藥物臨床試驗技術指導原則》制定,提出了從成人數據向兒科人群數據外推的原則和要求,進一步規范和指導我國兒科人群藥物臨床試驗。
《成人用藥數據外推至兒科人群的技術指導原則》制定,進一步鼓勵研制兒科用藥,最大程度利用已有數據,減少不必要的兒科研究,通過數據外推完善和豐富說明書中兒科人群用藥信息,指導臨床用藥。
《真實世界研究支持兒童藥物研發與審評的技術指導原則(試行)》的通告發布:(一)批準用于我國兒童的新活性成分藥品上市后臨床安全有效性研究;(二)境外已批準用于成人和兒童、我國人的藥品,采用數據外推策略申報。
《兒童用藥(化學藥品)藥學開發指導原則(試行)》發布,重點從給藥途徑和劑型的選擇、原料藥、輔料、包裝系統和給藥裝置、患者可接受性等方面闡述兒童用藥藥學開發的特點,旨在為兒童用藥的藥學開發提供研發思路和技術指導。
《兒科用藥臨床藥理學研究技術指導原則》發布,從兒科用藥臨床藥理學研究內容、特點、主要應用和研究方案設計要點等方面,對業界關注的數據外推和無法外推的情況進行了說明;通過數據外推,可減少或豁免部分兒科臨床試驗,優化兒科人群臨床試驗。
在兒童藥物優先審評審批方面,2016-2019年國家局已陸續將989個品種納入優先審評程序中,其中兒童藥物96件(占比為9.7%),已有80多個企業享受優惠政策。截至目前,通過兒童用藥優先審評審批上市的產品共計34個,詳見下表。
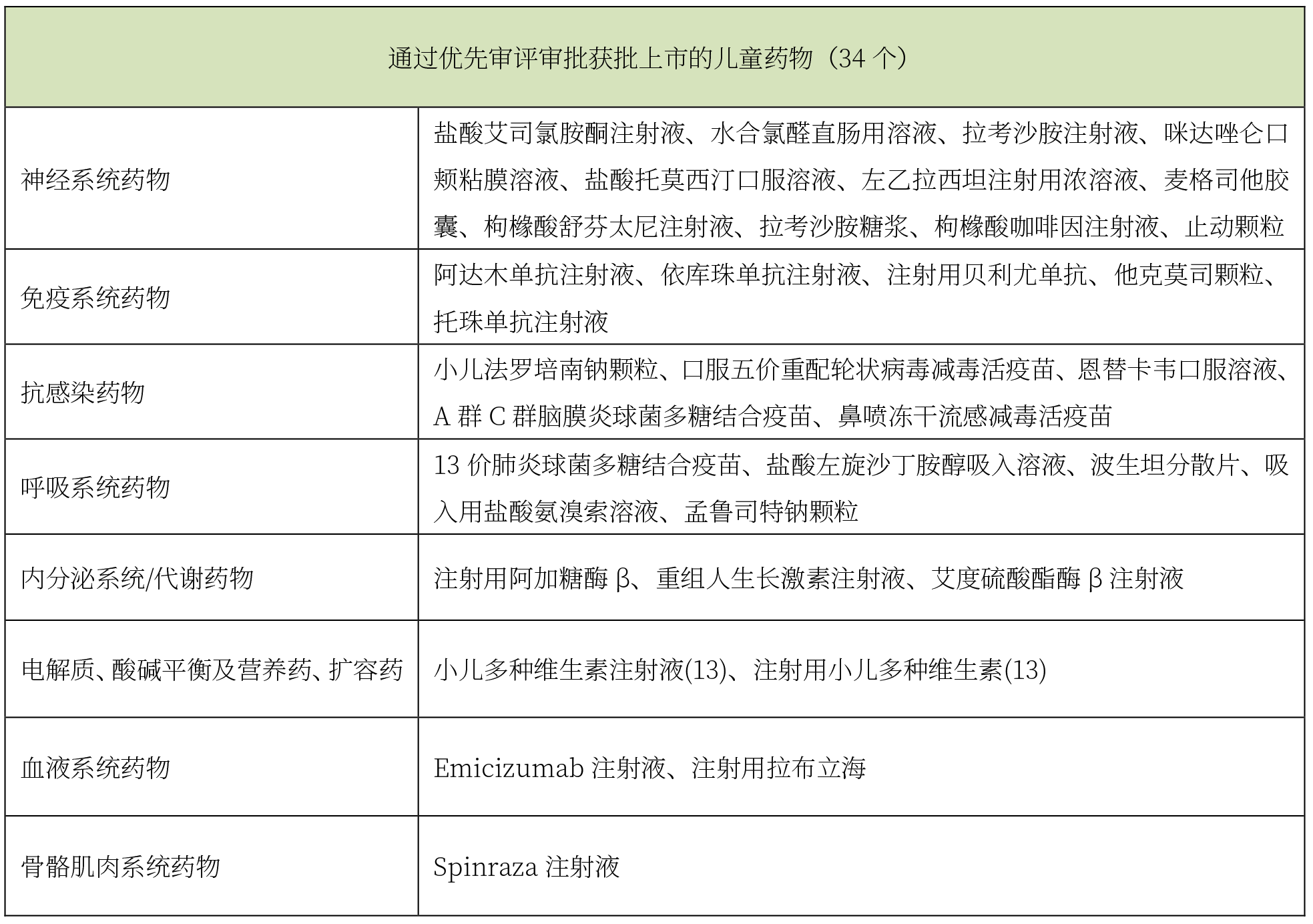
據Insight統計,在衛健委、工信部和國家藥監局聯合發布的106種鼓勵研發申報兒童藥品中,其中有83個品規暫無公開研發動態或相關研發信息,對于擬布局兒童藥物市場的企業,還有很多的選擇空間。
首批鼓勵研發申報兒童藥品清單(總計32個品種)中,有7個品種企業研發熱度較高,依次為左乙拉西坦注射液、普萘洛爾口服溶液、碳酸氫鈉注射劑、其他呋塞米口服溶液、咪達唑侖口腔黏膜溶液、尼莫地平口服溶液、水合氯醛灌腸液,水合氯醛口服溶液。
截止目前參與清單中項目研發的仿制藥企業共15家,分別為江蘇亞邦生緣、吉林津升、江蘇恒瑞、亞寶、石藥、湖北多瑞、新疆特豐、南京特豐、北京四環、成都倍特、海陵、海南普利、圣華曦、濟川、河北仁和益康等。

第二批鼓勵研發申報兒童藥品清單(總計40個品種)中,有7個品種在國內有公開研發動態,研發熱度依次為阿托品滴眼劑(3家)、胍法辛緩釋片(2家)、氨己烯酸散劑(2家)、埃索美拉唑顆粒劑(1家)、鹽酸二甲雙胍口服溶液劑(1家)、氯巴占片(1家)、吸入一氧化氮(1家)。在第二批清單中,國內企業參與熱度不高,截止目前僅有5家企業參與,分別為四川百利、濟南百諾、新疆特豐、宜昌人福、成都宛東。
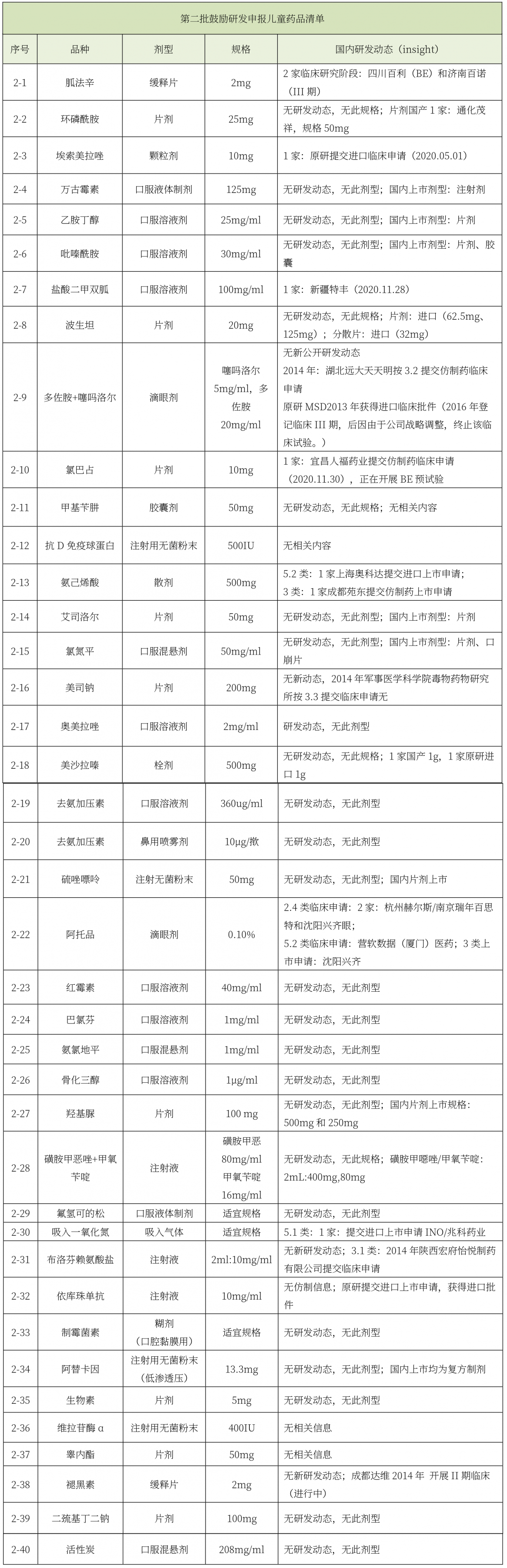
第三批鼓勵研發申報兒童藥品清單(總計34個品種)中,有6個品種有公開研發動態,研發熱度依次為鹽酸右美托咪定鼻用噴霧劑(3家)、鹽酸曲恩汀膠囊劑(2家)、纈沙坦口服溶液劑(2家)、西地那非口服混懸劑(1家)、依那普利口服溶液劑(1家)、苯丁酸鈉片劑(1家)、苯丁酸鈉散劑(1家)。參與研發的國內企業(9家)主要為河南藍天、四川普銳特、無錫濟煜山禾、恒瑞、成都因諾、廣州一品紅、常州四藥、珠海津之敦、兆科藥業。
1、以臨床需求為導向,開發申報鼓勵研發藥物、臨床急需藥物、短缺藥物:2016-2019年期間衛健委、工信部和食藥監局推出3批鼓勵研發申報兒童藥品清單共計108種,這些清單大部分為國外已上市,但國內缺乏的兒童適宜劑型和規格,該清單的發布為我國兒科用藥發展指明了方向。
2、規范說明書用藥:對于國內兒童,由于兒科用藥匱乏,臨床上存在超說明書用藥情形,包括超使用人群、適應癥、用法用量,對于臨床常用的超說用書用藥產品,可參照廣東省藥學會初版的歷年超藥品說明書用藥目錄、公開文獻、資料等篩選,結合企業產品線、科室渠道布局選擇相匹配的產品通過補充申請或者2.4類新藥申請方式增加使用人群、適應癥,規范臨床用藥,明確說明書標簽用藥。
3、布局仿制研發兒童適宜劑型,形成兒童特色品牌:顆粒劑、散劑、口服溶液、口服混懸液、口服滴劑、口服乳劑、細粒劑、口崩片、口溶膜劑、干混懸劑、咀嚼片、微片、片劑、分散片、膠囊、注射劑等。
歐盟針對不同年齡段兒童進行了劑型(口服給藥途徑)推薦:
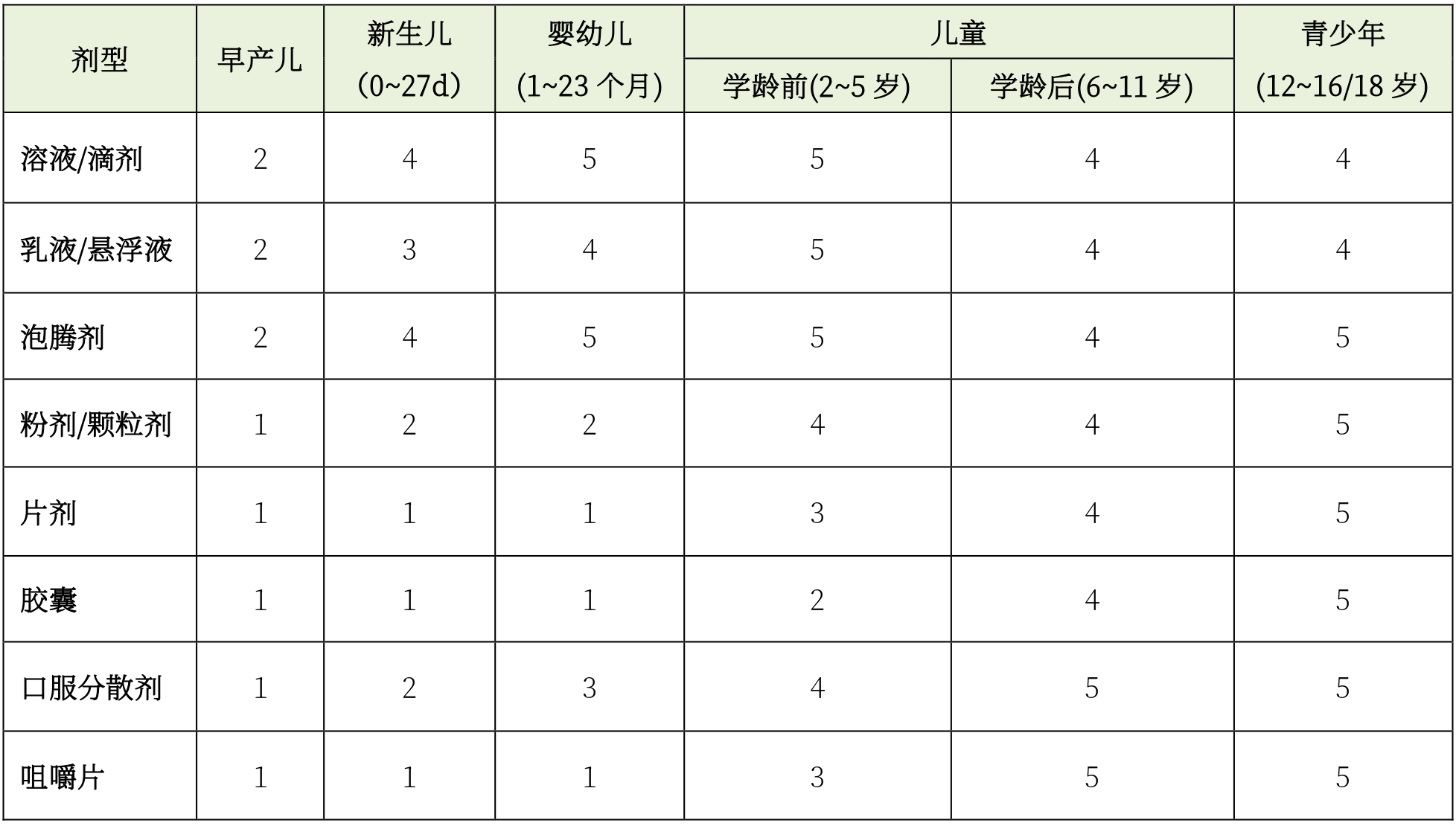
(指標1~5表示兒童對特定劑型的接受程度,數值越高,接受程度越高)
4、規范說明書用藥:對于國內兒童,由于兒科用藥匱乏,臨床上存在超說明書用藥情形,包括超使用人群、適應癥、用法用量,對于臨床常用的超說用書用藥產品,可參照廣東省藥學會初版的歷年超藥品說明書用藥目錄、公開文獻、資料等篩選,結合企業產品線、科室渠道布局選擇相匹配的產品通過補充申請或者2.4類新藥申請方式增加使用人群、適應癥,規范臨床用藥,明確說明書標簽用藥。
5、布局仿制研發兒童適宜劑型,形成兒童特色品牌:顆粒劑、散劑、口服溶液、口服混懸液、口服滴劑、口服乳劑、細粒劑、口崩片、口溶膜劑、干混懸劑、咀嚼片、微片、片劑、分散片、膠囊、注射劑等。
我國目前有2.2億兒童(0~14歲),人口基數大,自二胎政策全面實施后,預計兒童人口將進一步增長,然而國內兒童用藥市場在藥品品種、劑型和規格等方面還是相對匱乏,兒童專用藥物占比不足3%,與人口數量的增長極為不匹配,兒童專用藥短板亟須補上。
為鼓勵兒童藥物的研發和生產,國家頻頻出臺系列利好政策、指導原則,為企業開發兒童藥物指明方向,基藥目錄、醫保目錄重點聚焦兒童藥品,倡導優先納入原則,提高企業研發熱情,提升兒童藥物的可及性;與此同時,國內綜合醫院兒科門診量、兒童醫院、婦幼保健院在不斷增長;兒科“成團”發展,實現患兒分散就近就醫等等。這一系列政策、措施給兒童藥市場帶來了廣闊的需求,預測未來兒童藥市場規模將保持年均10%以上的速度增長,千億兒童藥物市場即將迎來前所未有的發展機遇。
-END-
關于我們:
綜合信息部由20名成員組成,其中總監1名、經理2名、副經理1名、主管1名、藥理專員15名,均來自北京大學、中國醫學科學院北京協和醫學院等國內外知名院校。綜合信息部主要負責公司的國際/國內項目立項、品種市場信息支持、公司知識產權維護及撰寫臨床/藥理相關申報材料,為公司研發提供信息保障。
部門下設5個中心,其中仿創藥立項策略中心主要負責仿制藥、創新藥品種立項;臨床&藥理中心負責相關申報材料撰寫;知識產權中心負責公司知識產權維護;大數據分析中心負責國內外品種信息分析、企業產品管線規劃及戰略合作伙伴個性化信息支持;國際新產品策略中心關注國際原料藥、裝置、制劑品種信息,提供中美、中歐雙報立項信息。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
