政策法規||本周重磅政策法規概覽(21.02.22-21.02.26)
01
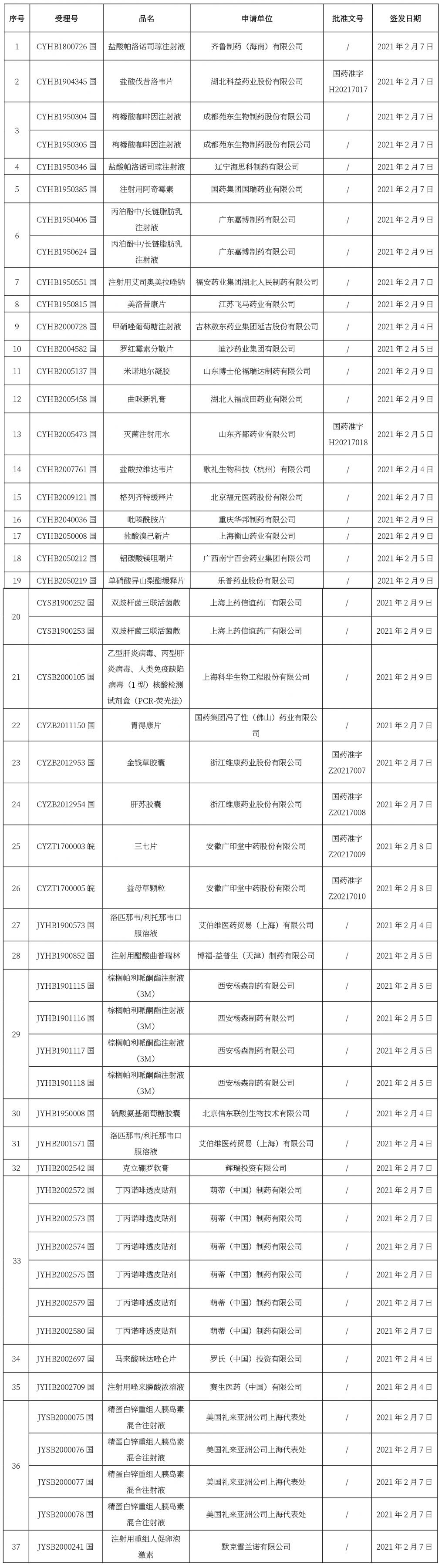
本周共計37個品種獲批取得藥品批準證明文件,其中一致性評價品種10個,包括注射劑品種6個。
關于發布《已上市中藥變更事項及申報資料要求》的通告(2021年第19號)
掃描圖中二維碼
查看詳細信息

關于發布仿制藥參比制劑目錄(第三十八批)的通告(2021年 第18號)

掃描圖中二維碼
查看詳細信息

04
關于2020年檢驗能力驗證計劃滿意結果的通報
掃描圖中二維碼
查看詳細信息

關于發布《藥審中心技術審評報告公開工作規范(試行)》的通告(2021年第19號)

掃描圖中二維碼
查看詳細信息

02
關于公開征求《基因修飾細胞治療產品非臨床研究與評價技術指導原則》(試行)意見的通知

掃描圖中二維碼
查看詳細信息

03
關于發布《放射性體內診斷藥物非臨床研究技術指導原則》的通告(2021年第20號)

掃描圖中二維碼
查看詳細信息

04
關于ICH Q5D、M9及M9問答實施建議公開征求意見的通知

掃描圖中二維碼
查看詳細信息

藥品注冊申請人在線確認“待核查品種信息”常見問題解答(三)
Q1
新注冊辦法實施前申報的原料藥品種,目前尚未完成工藝驗證,注冊現場核查前在填寫申請表時,是否可以另附說明,承諾在一定時限內完成工藝驗證,然后安排核查?
答:不可以的。商業規模的工藝驗證是說明注冊申請的藥品在預定工藝參數范圍內運行的生產工藝可以持續有效地生產出符合預定質量產品的重要證據,無論新注冊管理辦法實施之前還是之后受理的品種,在提交注冊核查申請表或確認表之前,必須完成商業規模的工藝驗證。
Q2
我司產品即將接受注冊現場核查,CDE發補時對一些生產參數的提出了收緊的要求,我司在制造檢定規程中已經修改并提交至CDE,但是目前階段上述參數是否得到CDE的認可,后續是否還會有修改,我們還不確定,所以在制檢規程中上述參數并未更新,注冊現場核查時,我司是否需要將工藝規程中的參數更新,與提交給CDE的制造工藝規程參數一致?
答:確實存在您所描述的情形。因目前需要申請人提交的確認表,包括3個附件,其中關鍵生產批次的變更情況可以在表3即《關鍵批次與申報資料變化情況匯總表》中予以說明。
Q3
聯合核查情況下,CFDI是否規定各環節的時限,特別是核查結束后,省局審核報告完成并報送CFDI的時限,經常有超過1個月還未寄到CFDI?
答:鑒于疫情的不可預見性,目前沒有專門規定各省聯合核查任務完成的具體時限。從2020年聯合核查任務完成情況數據統計來看:檢查組完成現場核查后,檢查組報告和省局審核意見報告返回CFDI的平均時間約30天(日歷日),對于需要省局確認核查發現缺陷整改落實情況的,在對企業的整改報告審核后省局才能出具審核意見,返回CFDI的時間會加長。企業整改時間會影響省局審核意見的時間,CFDI有專人就聯合核查的情況同各省局保持溝通交流,發現異常情形會督促省局加快辦理。
Q4
核查任務的管理時限是工作日還是日歷日?
答:是工作日。
Q5
注冊核查企業能否申請延遲核查?
答:申請人在規定的時限內可以申請延遲核查。根據目前注冊核查工作程序,除了自然災害、政府行為等不可抗力的正當理由外,申請人未在規定的時限內進行生產現場核查確認,或不能在規定的時限內接受現場核查的,核查中心可以終止相關核查任務,說明原因和依據后告知CDE。需要請大家關注的是,新版《藥品注冊管理辦法》實施前后受理的藥品注冊申請,現場檢查時限規定是有不同的。
藥典委
本周珍黃胃片、強力定眩片、胃瘍寧丸國家藥品標準草案的公示;腰痛寧膠囊藥典標準草案公示;培化磷脂酰乙醇胺、二硬脂酰磷脂酰膽堿、二硬脂酰磷脂酰甘油鈉藥用輔料標準草案的公示;鹽酸替扎尼定、鹽酸替扎尼定片國家藥品標準修訂草案的公示。
掃描圖中二維碼
查看詳細信息

-END-
關于我們:
藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發、注冊申報、現場核查等一體化專業技術服務為宗旨,以高效、成功申報項目最終目標。
藥政部擁有一支技術與注冊經驗豐富的團隊,作為一家提供專業服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業且豐富的經驗,已助力成功申報多項藥品注冊申請,在業內具有良好的口碑。
部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業能力、豐富注冊經驗、拓展業務范圍,致力于為客戶提供高效率、高質量、合規的技術服務,為保護和促進公眾健康而不懈努力。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
