策略分析 | 罕見病用藥領域市場現狀、法規剖析及開發策略
罕見疾病是人類醫學面臨的最大挑戰之一,目前已知的罕見病有近7000種,約占人類疾病的10%。在種類繁多的罕見病當中,約有80%是由于基因缺陷所導致的,具有遺傳性。因罕見病患病人數少,治療罕見疾病的藥物也被稱為“孤兒藥(orphan drug)”。
由于各國的罕見病政策壁壘,這些藥物只在為數不多的國家和地區上市,包括中國在內的更多國家的患者,面臨無藥可醫的窘境,罕見病日漸成為一個全球公共健康優先事務。
2016年,據復旦大學出生缺陷研究中心數據顯示,我國約有1680萬罕見病患者。目前,中國尚無罕見病官方定義,專家共識為患病率低于1/50萬,或新生兒發病率低于0.1‰的疾病。
? 定義:
? 罕見病用藥短缺嚴重,主要依賴進口:
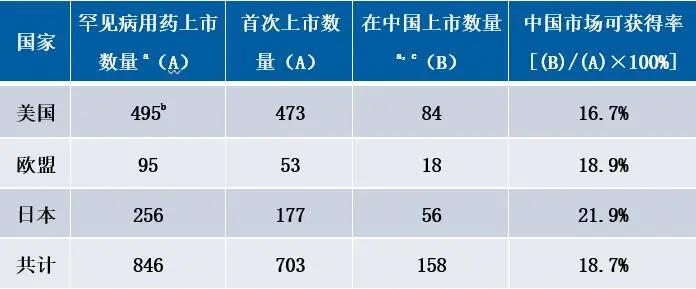
來源:FDA官網整理
備注:a指罕見病用藥的種類;b包含撤回的罕見病用藥;c截止2018年9月30日。
? 較多罕見病治療領域用藥可獲得性較低:

來源:FDA官網整理
其中,在眾多治療領域中,消化系統及代謝治療領域、抗寄生蟲治療領域和皮膚病治療領域可獲得性占比為零,罕見病市場具有較大的缺口。
? 2017年前法規——實現鼓勵到支持的轉變、特殊審評通道:
2007
-
《藥品注冊管理辦法》:特殊審評。
2009
-
新藥注冊審批管理規定:單獨設立審評審批通道、 多途徑動態補充資料、 多渠道溝通交流。
2013
-
關于深化藥品審批改革進一步鼓勵藥物創新:對重大疾病、罕見病、老年人和兒童疾病具有更好治療作用、具有自主知識產權的創新藥物注冊申請等,給予加快審評。確立仿制藥優先審評領域。罕見病可實行優先審評。
2015
-
《關于藥品注冊審評審批若干政策的公告》:加快臨床繼續等藥品的審批;對防治艾滋病、惡性腫瘤、重大傳染病和罕見病等疾病的創新藥注冊審評。
2017
-
《關于鼓勵藥品創新實行有限審評審批的意見》:防治罕見病且具有臨床優勢的藥品。
-
《關于深化審評審批制度改革管理鼓勵藥品醫療器械創新的意見》:支持罕見病用藥研發;可提出減免臨床試驗的申請。
? 新版《藥品管理法》——優先配置審評資源,縮短審評時限:
2019
-
《藥品管理法》:
第十六條:國家支持以臨床價值為導向、對人的疾病具有明確或者特殊療效的藥物創新,鼓勵具有新的治療機理、治療嚴重危及生命的疾病或者罕見病、對人體具有多靶向系統性調節干預功能等的新藥研制,推動藥品技術進步。
第六十六條:國家鼓勵短缺藥品的研制和生產,對臨床急需的短缺藥品、防治重大傳染病和罕見病等疾病的新藥予以優先審評審批。
2020
-
《藥品注冊管理辦法》:
第六十八條:藥品上市許可申請時,以下具有明顯臨床價值的藥品,可以申請適用優先審評審批程序:臨床急需的短缺藥品、防治重大傳染病和罕見病等疾病的創新藥和改良型新藥。
第九十六條:藥品上市許可申請審評時限為二百日,其中優先審評審批程序的審評時限為一百三十日。
? 新版《藥品管理法》——特殊審評審批:
2020
-
突破性治療藥物工作程序:
適用范圍:用于防治嚴重危及生命或者嚴重影響生存質量的疾病且尚無有效防治手段或者與現有治療手段相比有足夠證據表明具有明顯臨床優勢的創新藥或者改良型新藥。
適用時期:藥物臨床試驗期間。
政策優惠:研發期間溝通交流 臨床試驗研制指導。優先配置資源溝通交流, 加強指導,促進藥物研發。
-
優先審評審批工作程序
適用范圍:藥品具有明顯臨床價值,臨床急需的短缺藥品、防治重大傳染病和罕見病等疾病的創新藥和改良型新藥。
審評時限:藥品上市許可申請審評時限為二百日,其中優先審評審批程序的審評時限為一百三十日。
審批時限:行政審批決定應當在10日內作出。
補充提交技術資料:在審評期間提交技術資料,不延長審評時限。
? 罕見病用藥開發激勵措施:

隨著相關政策法規的進一步完善, 越來越多治療罕見病的藥物進行申報審批。

*2020年版《藥品注冊管理辦法》后,臨床急需的短缺藥品、防治重大傳染病和罕見病等疾病的創新藥和改良型新藥合并計算
? 適應癥重新定位:
-
開發常見疾病治療藥物在罕見病治療領域的新適應癥。
-
開發罕見病用藥物針對其他罕見病的新適應癥。
-
開發罕見病用藥物針對常見疾病的新適應癥。
eg:2017年,FDA批準上市的罕見病用藥中,約9.83%的罕見病用藥有2種及2種以上的罕見病適應癥。
? 罕見疾病藥物臨床試驗開發計劃示例:
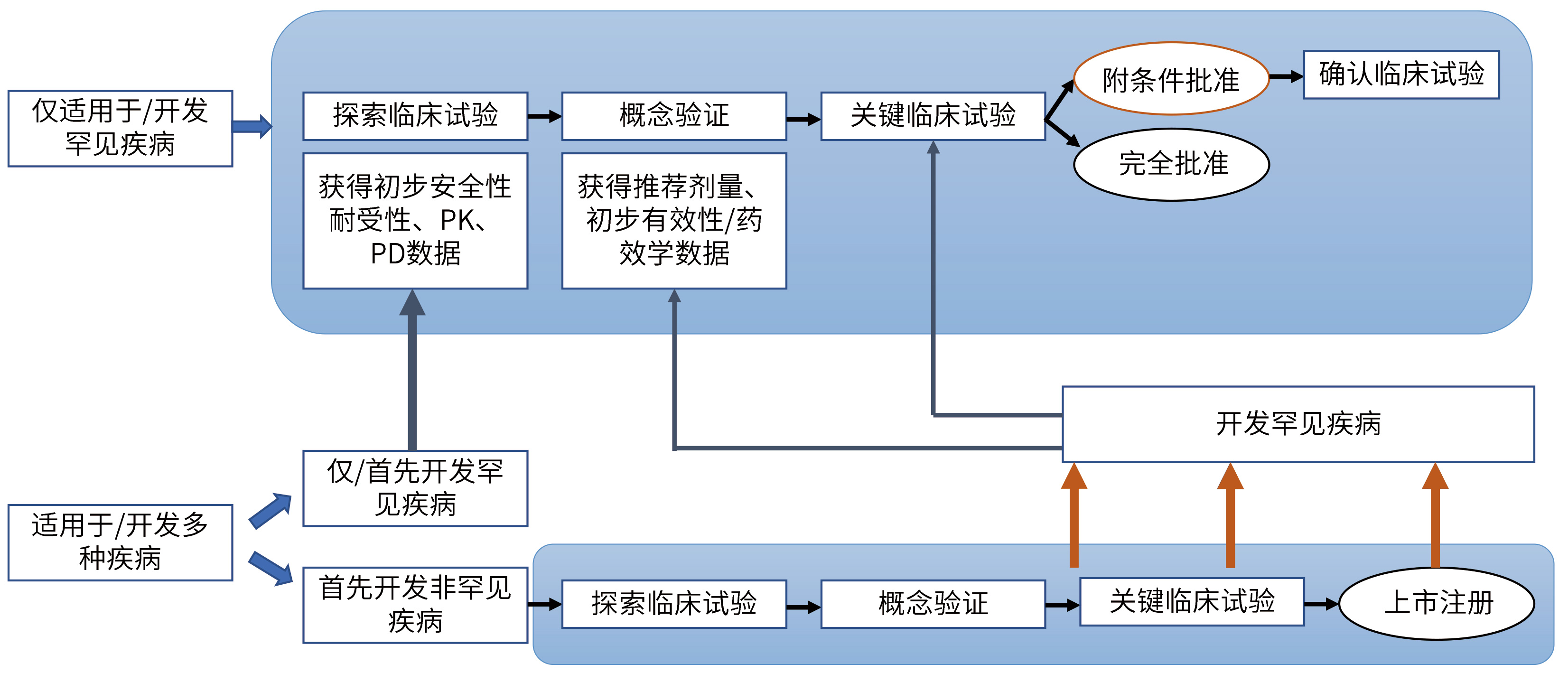
在仿制藥市場紅利逐漸較弱的情況下,企業不妨抓住政策機遇,可另辟蹊徑,采用license in或與深耕罕見病研發的國內外研究機構合作,布局罕見病領域,提前搶占罕見病用藥市場。
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
