政策法規||國家藥監局藥審中心關于發布《抗腫瘤藥物說明書不良反應數據匯總指導原則》的通告(附本周法規概覽04.18-04.22)
01
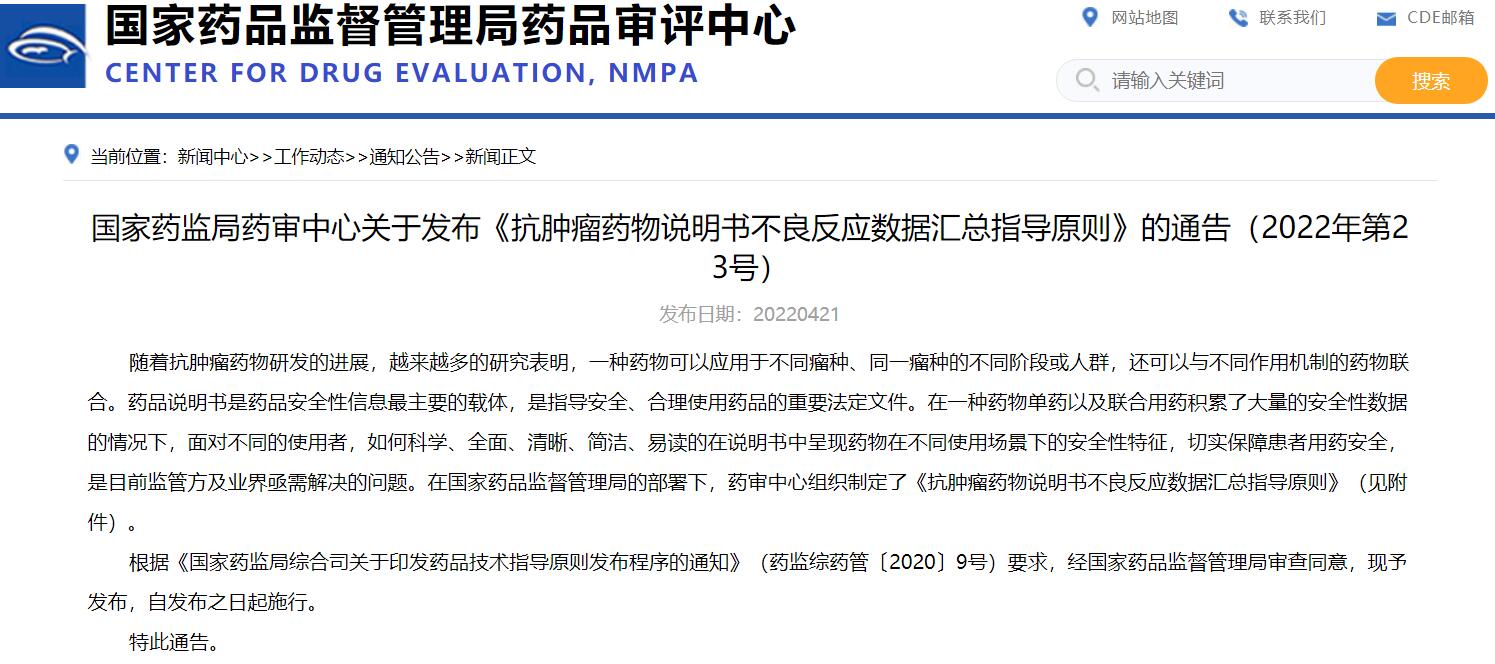
國家藥監局藥審中心關于發布《抗腫瘤藥物說明書不良反應數據匯總指導原則》的通告(2022年第23號)
在一種藥物單藥以及聯合用藥積累了大量的安全性數據的情況下,面對不同的使用者,如何科學、全面、清晰、簡潔、易讀的在說明書中呈現藥物在不同使用場景下的安全性特征,切實保障患者用藥安全,是目前監管方及業界亟需解決的問題。在國家藥品監督管理局的部署下,藥審中心組織制定了《抗腫瘤藥物說明書不良反應數據匯總指導原則》。
掃描識別圖中二維碼
查看詳細信息

02
關于公開征求《已上市藥品說明書增補兒童用藥信息工作程序》及《藥審中心關于已上市藥品說明書增補兒童用藥信息的工作流程》意見的通知
推動解決我國兒科臨床普遍存在的說明書兒童用藥信息增補或修訂滯后的問題,確保說明書修訂的質量和效率,藥審中心起草了《已上市藥品說明書增補兒童用藥信息工作程序》及《藥審中心關于已上市藥品說明書增補兒童用藥信息的工作流程》。

掃描識別圖中二維碼
查看詳細信息

03
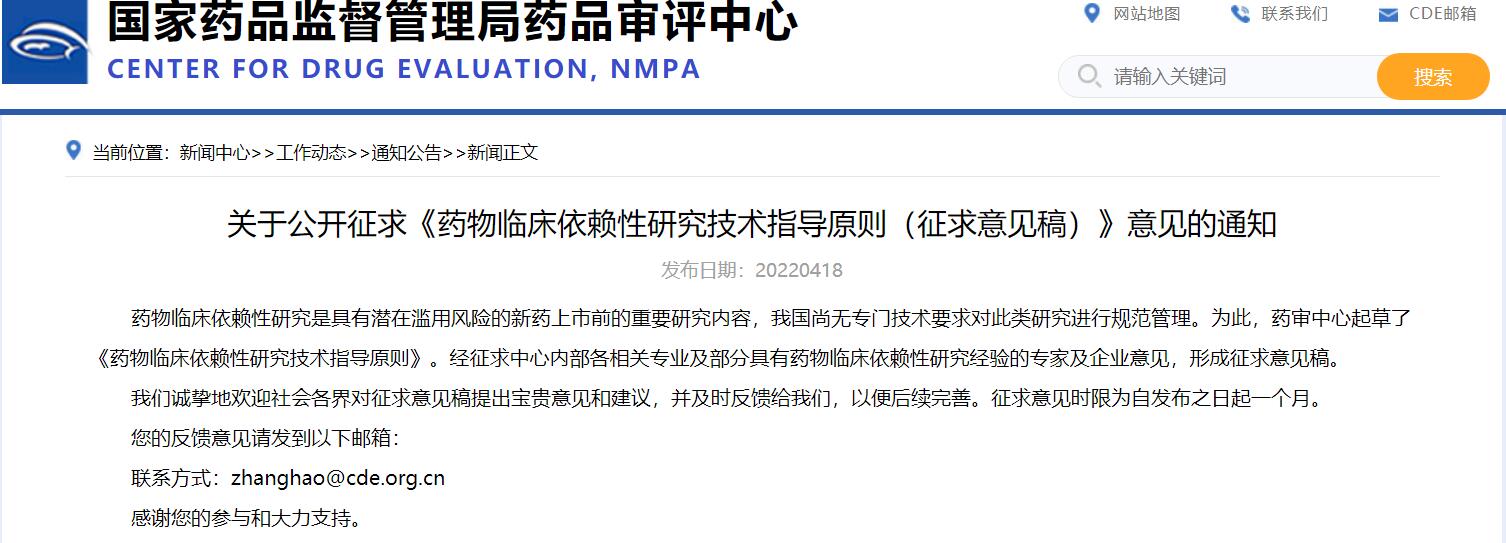
關于公開征求《藥物臨床依賴性研究技術指導原則(征求意見稿)》意見的通知
藥物臨床依賴性研究是具有潛在濫用風險的新藥上市前的重要研究內容,我國尚無專門技術要求對此類研究進行規范管理。為此,藥審中心起草了《藥物臨床依賴性研究技術指導原則》。
掃描識別圖中二維碼
查看詳細信息

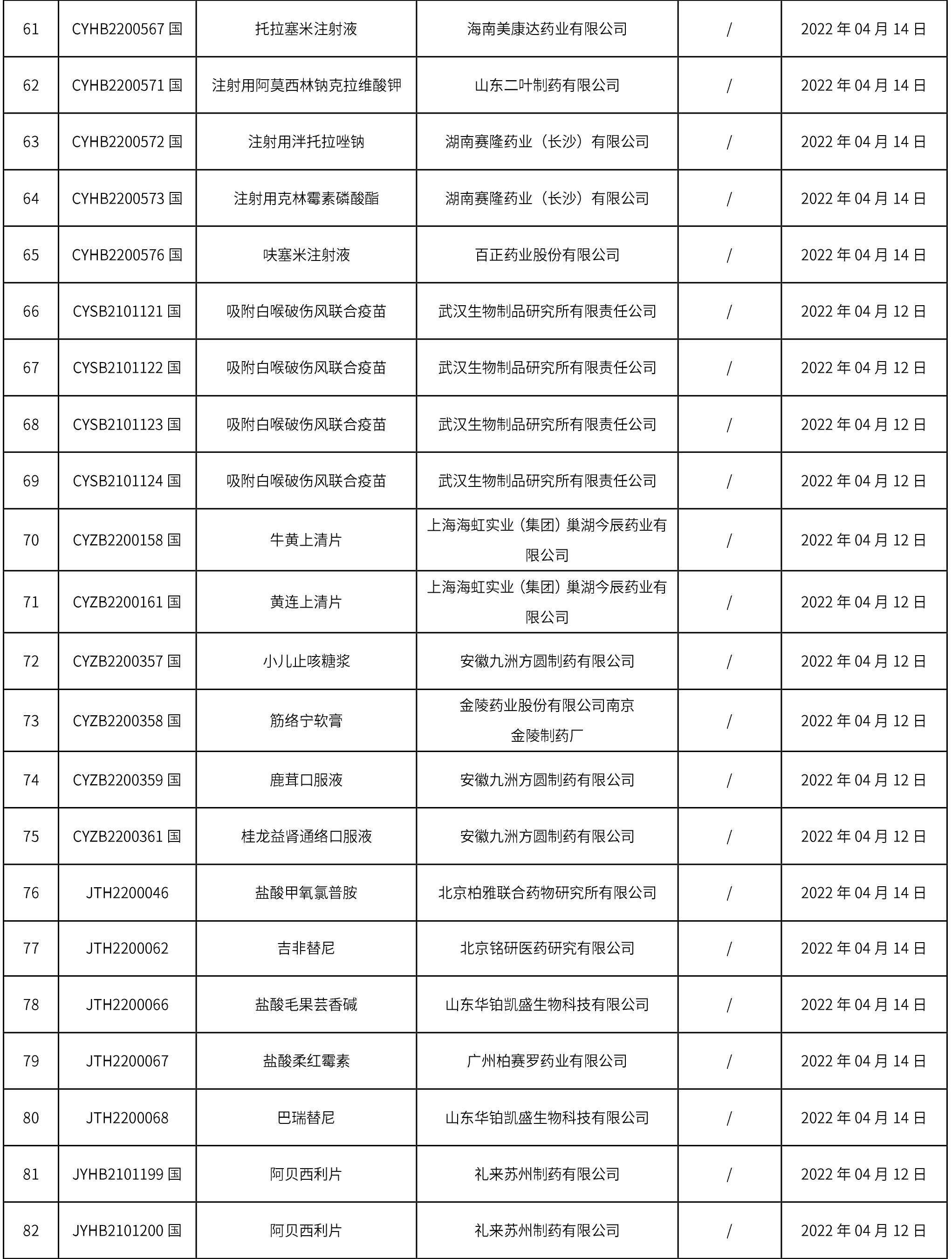
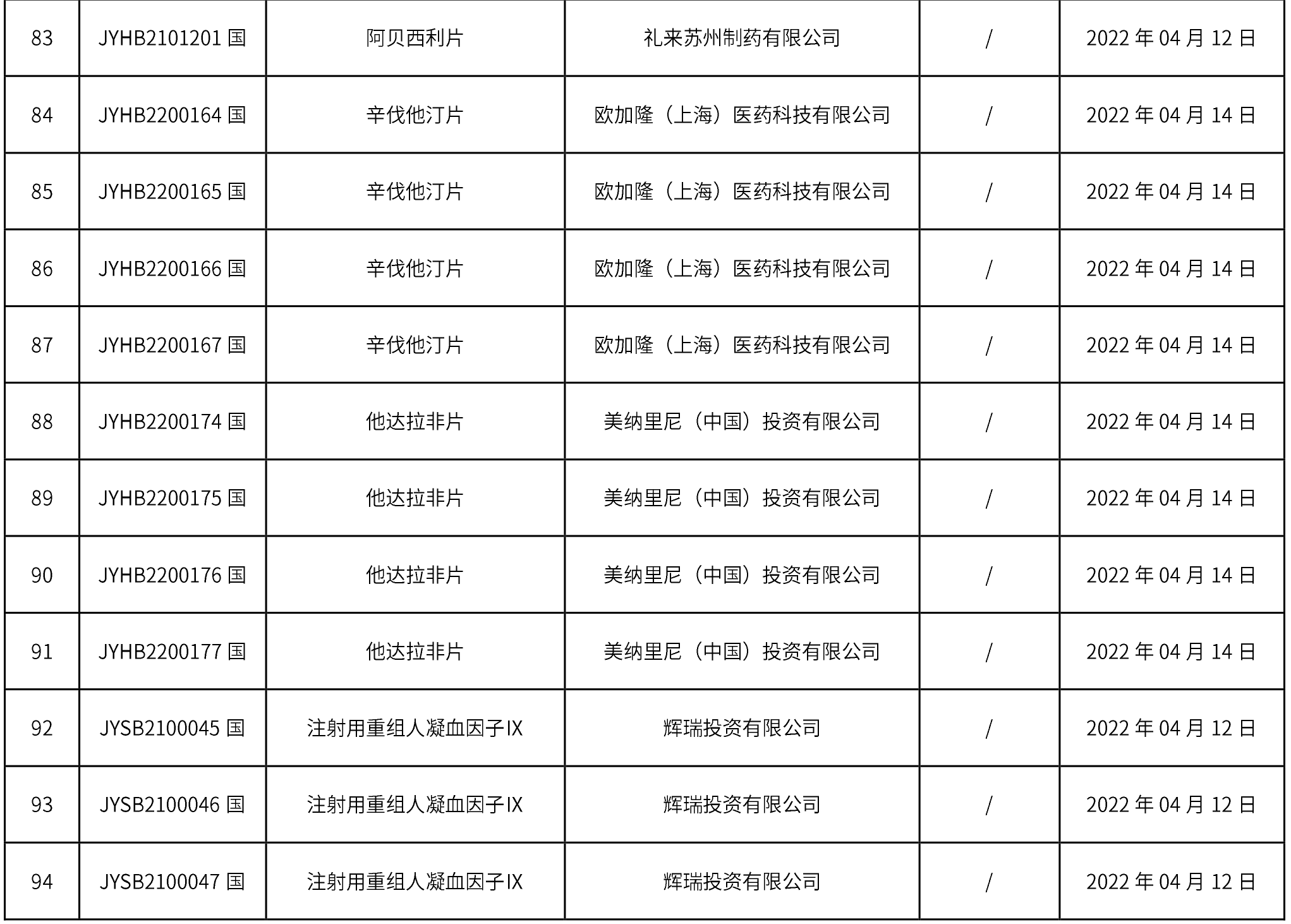
1、本周共計個94品規取得藥品批準證明文件,其中一致性評價品規7個,注射劑34個。
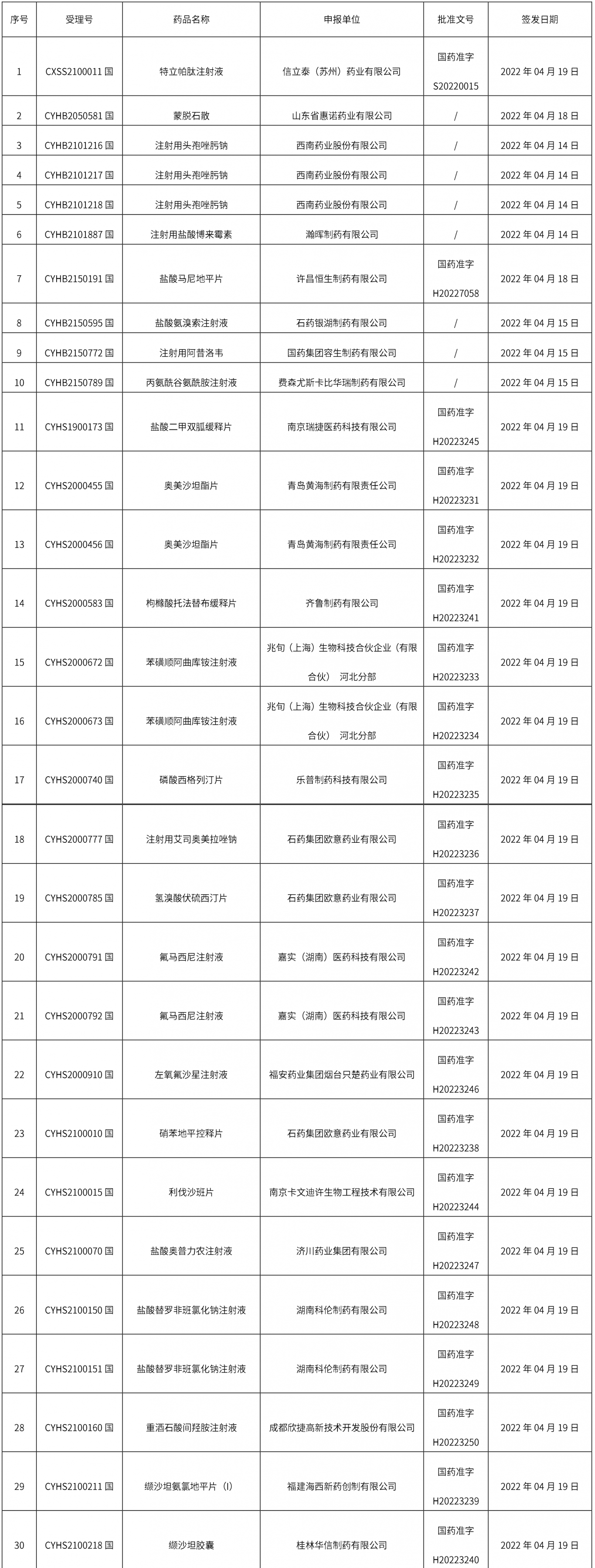
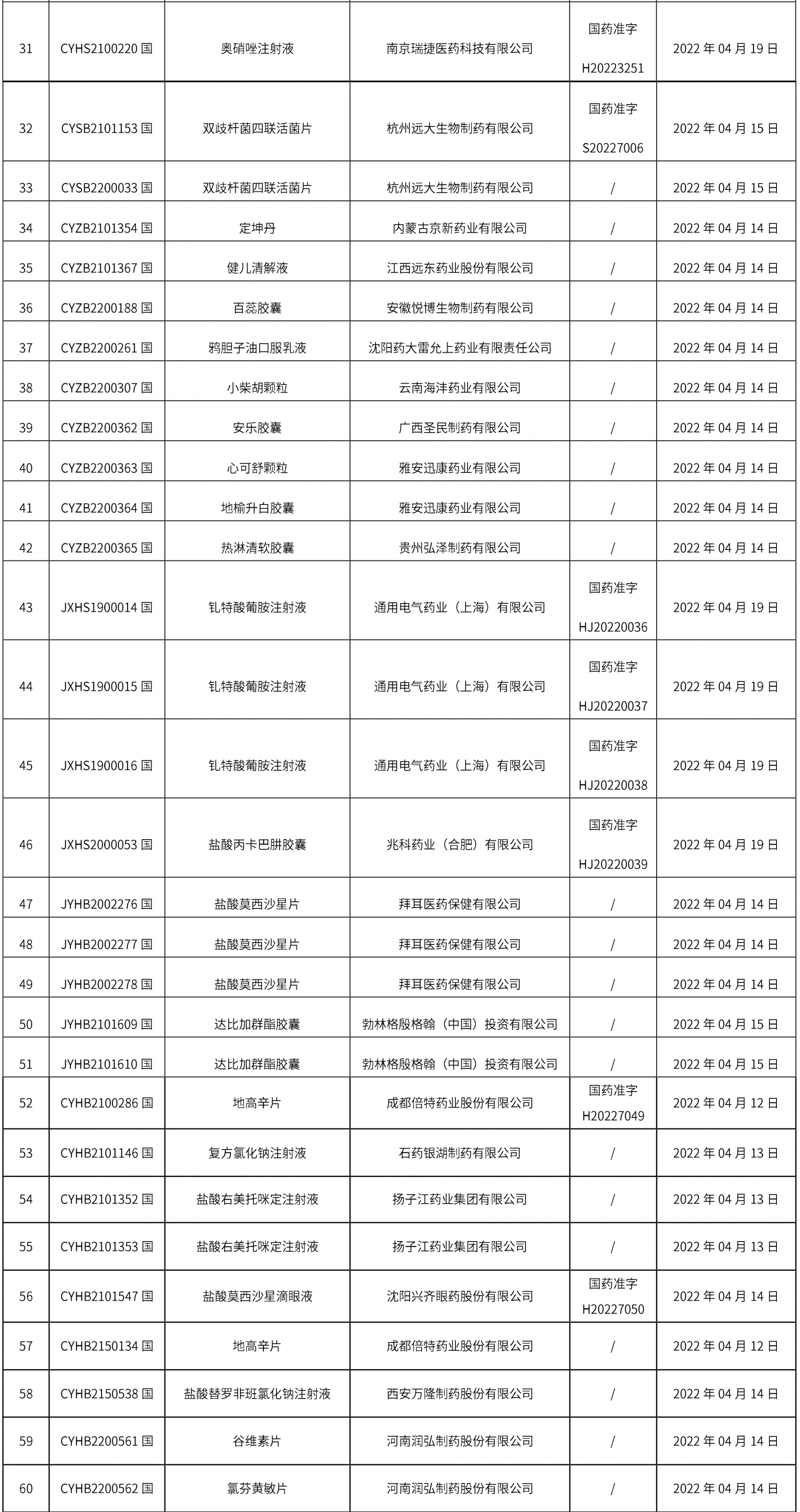
本周共發布2個藥品標準草案的公示。
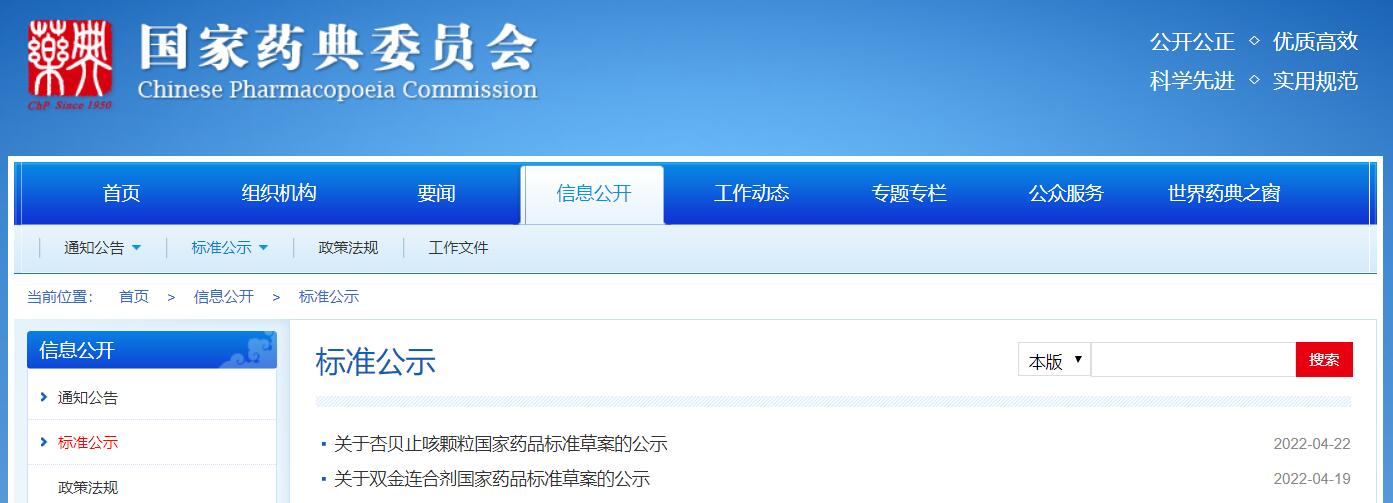
掃描識別圖中二維碼
查看詳細信息

-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
