劃重點!我國保健食品注冊和備案須知(附各國保健食品定義與監管區別)
保健食品指的是由特定人群食用,不以治療疾病為目的,具有保健功能或者以補充維生素、礦物質等營養物質為目的,不對人體產生危害的食品。保健食品與嬰幼兒配方食品、特殊膳食食品、特殊醫學用途配方食品同屬于食品項下的特殊食品。
保健食品法規歷史沿革
- 2005-2013年:隨著經濟發展,保健食品行業初步發展,海外保健食品風靡中國
- 2014年:國務院發布《中國食物與營養發展綱要(2014-2020)》。
- 2015年:新修訂《中華人民共和國食品安全法》,實行保健食品的注冊與備案分類管理,規定了保健食品原料目錄和功能目錄。
- 2016年:CFDA發布《保健食品注冊與備案管理辦法》,實行注冊+備案雙軌管理。
- 2017年:CFDA發布《保健食品備案工作細則》,備案系統上線;國務院發布《國民營養計劃(2017-2030年)》。
- 2019年:國家市場監督管理總局發布《保健食品原料目錄和功能目錄管理辦法》。
- 2020年:首批非營養素補充劑目錄上線。
使用保健食品原料目錄以外原料(以下簡稱目錄外原料)的保健食品和首次進口的保健食品(屬于補充維生素、礦物質等營養物質的保健食品除外)應當提出注冊申請,由國家市場監督管理總局批準注冊上市。
保健食品注冊時需注意:
-
注冊人申請人應當是在中國境內登記的法人或者其他組織
-
產品聲稱的保健功能應當已經列入保健食品功能目錄
-
進口保健食品的注冊人,應當是上市保健食品境外生產廠商
我國保健食品注冊流程圖
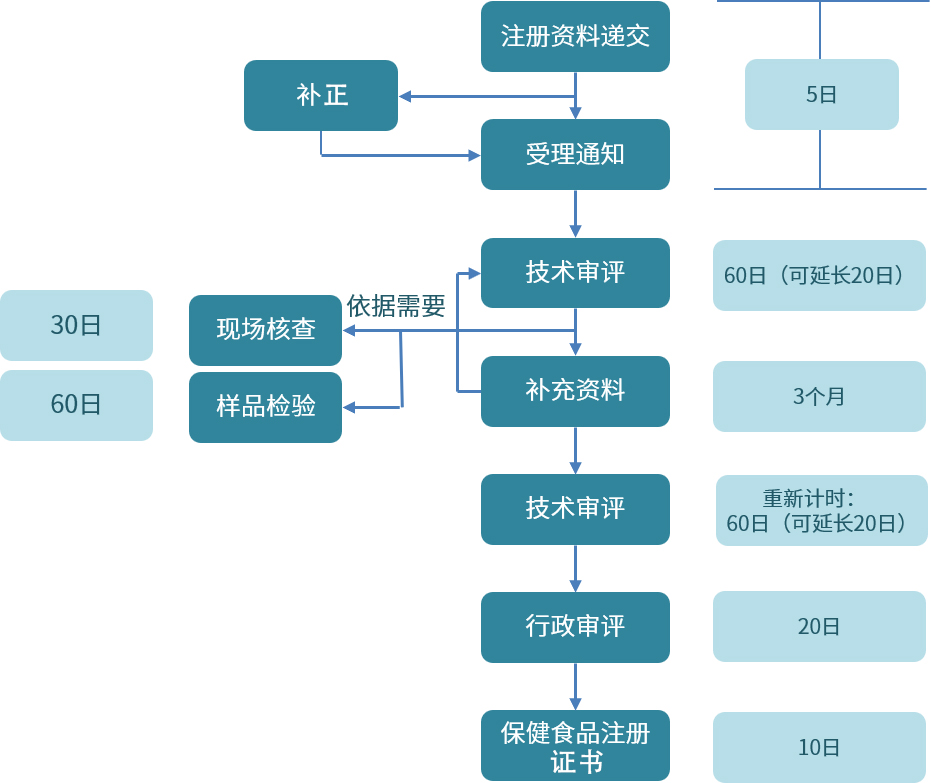
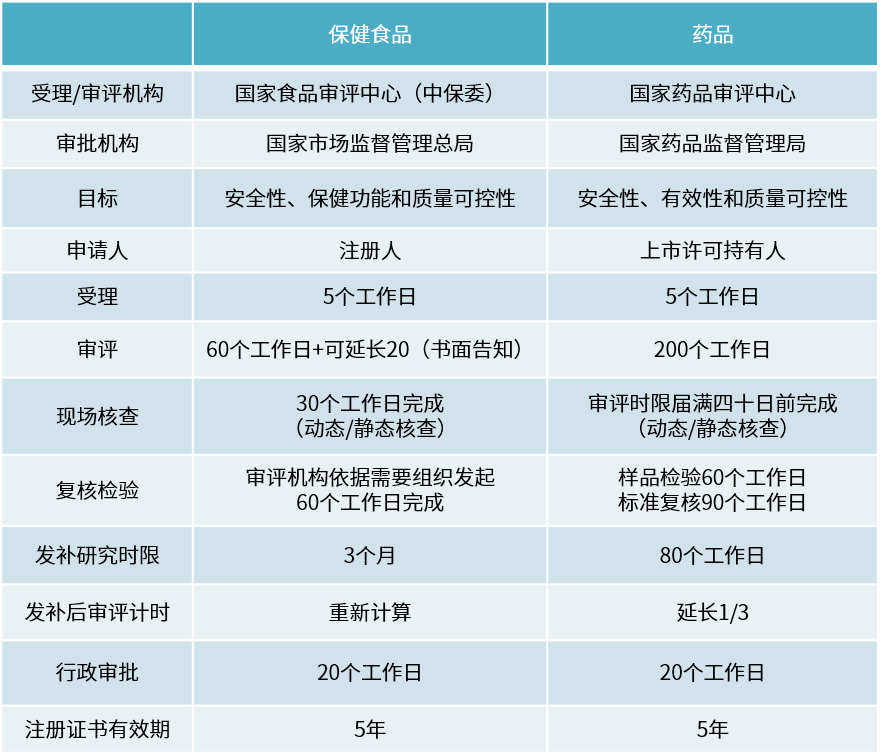
境內生產保健食品注冊與藥品注冊流程對比表
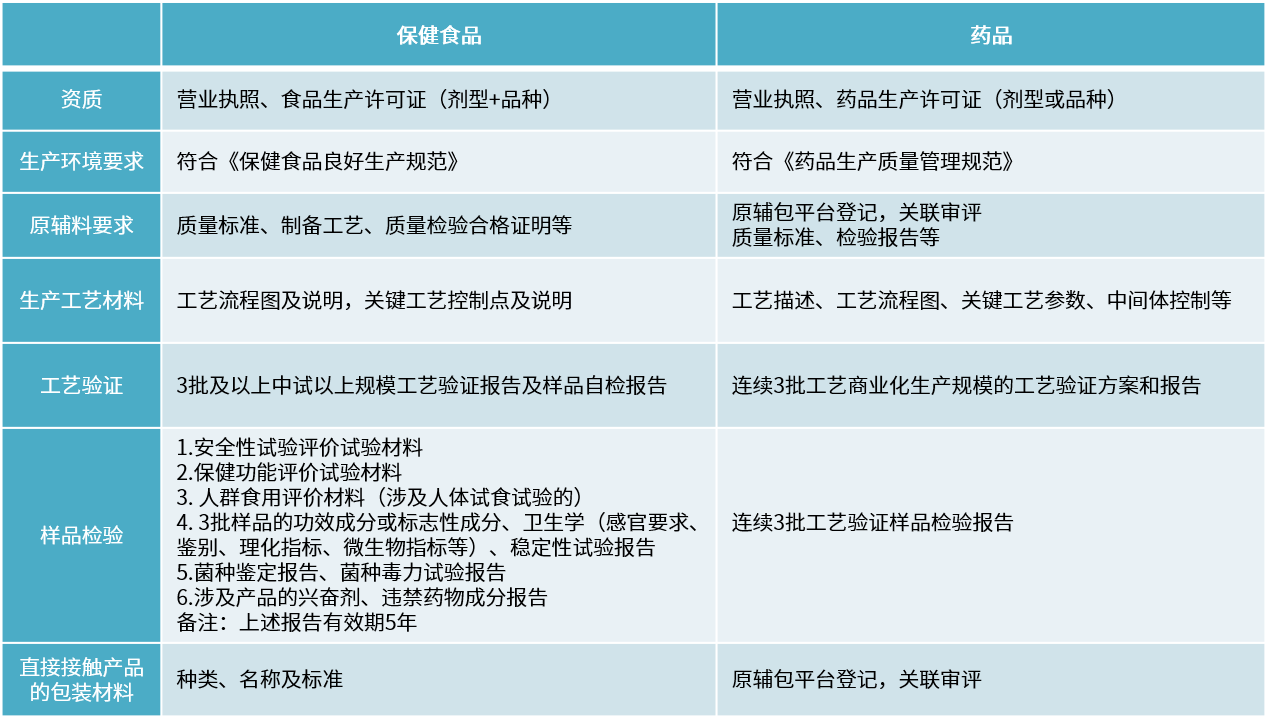
資料要求
-
保健食品注冊申請表和申請人對申請材料真實性負責的法律責任承諾書
-
注冊申請人主體登記證明文件復印件
-
產品研發報告(研制過程、中試以上驗證)
-
產品配方材料(原料和輔料的名稱及用量、生產工藝、質量標準)
-
產品生產工藝材料,包括生產工藝流程簡圖及說明、關鍵工藝控制點及說明
-
安全性和保健功能評價材料(包括目錄外原料及產品的安全性、保健功能試驗評價材料,人群食用評價材料,功效成分或者標志性成分、衛生學、穩定性等)
-
直接接觸保健食品的包裝材料信息
-
產品標簽、說明書樣稿
-
產品名稱中的通用名與注冊的藥品名稱不重名的檢索材料
-
3個最小銷售包裝樣品
保健食品與藥品部分要求對比
使用的原料已經列入保健食品原料目錄的保健食品和首次進口的以補充維生素、礦物質等營養物質為目的的保健食品應當經省市場監督管理局備案。
保健食品備案時需注意:
-
備案人應當是保健食品生產企業,原注冊人可以作為備案人
-
進口保健食品的備案人,應當是上市保健食品境外生產廠商
資料要求
-
保健食品備案登記表和備案人對提交材料真實性負責的法律責任承諾書
-
備案人主體登記證明文件復印件
-
產品技術要求材料
-
具有合法資質的檢驗機構出具的符合產品技術要求全項目檢驗報告
-
其他表明產品安全性和保健功能的材料
-
產品配方材料(原料和輔料的名稱及用量、生產工藝、質量標準)
-
產品生產工藝材料,包括生產工藝流程簡圖及說明、關鍵工藝控制點及說明
-
安全性和保健功能評價材料(包括目錄外原料及產品的安全性、保健功能試驗評價材料,人群食用評價材料,功效成分或者標志性成分、衛生學、穩定性、菌種鑒定、菌種毒力等試驗報告,以及涉及興奮劑、違禁藥物成分等檢測報告等)
-
直接接觸保健食品的包裝材料信息
-
產品標簽、說明書樣稿
-
產品名稱中的通用名與注冊的藥品名稱不重名的檢索材料
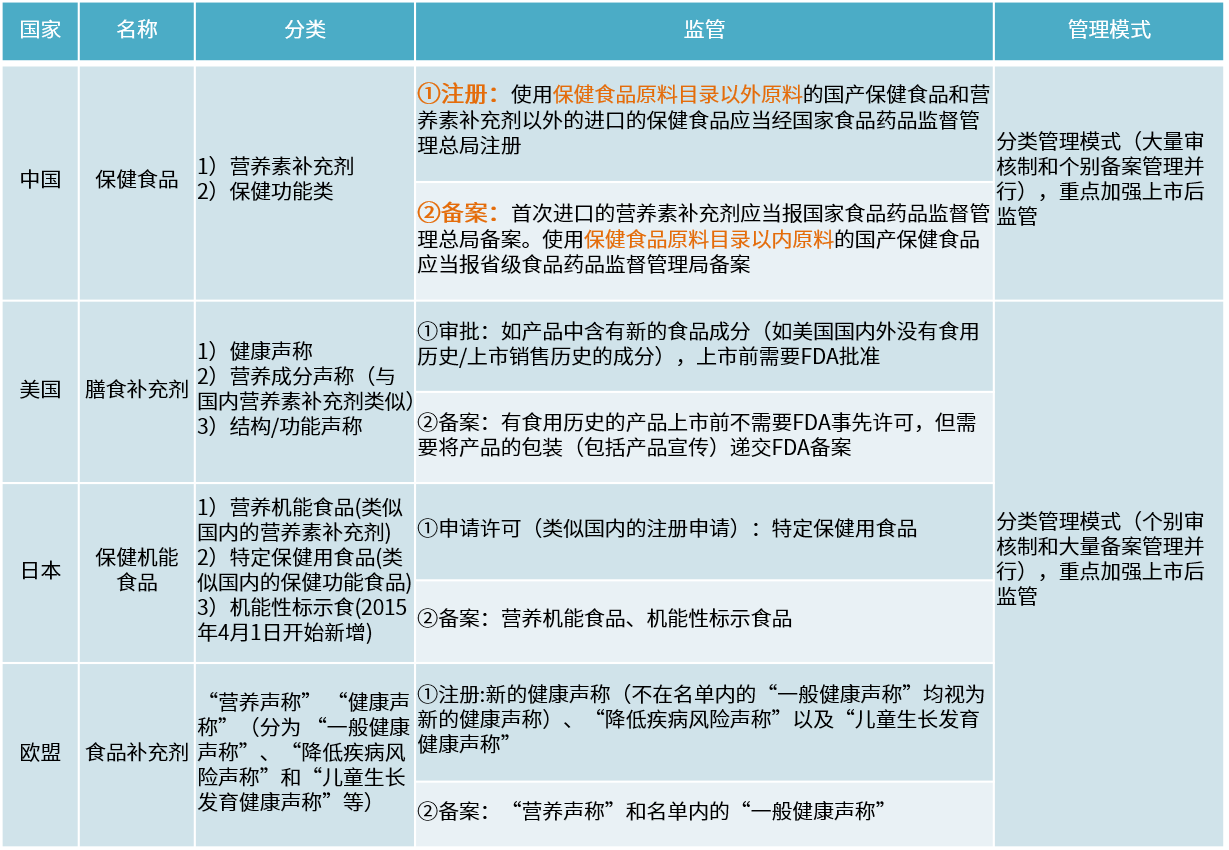
附各國保健食品定義與監管區別:
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
