臨研解讀 | 臨床試驗數據監查委員會(DMC),一文讀懂!
? 確證性臨床試驗,多國家、多中心、大樣本的試驗;
? 觀察周期長的臨床試驗;
? 安全性風險高的試驗;
? 治療針對的是危及生命的疾病,受試者是死亡風險較高的人群;
? 受試者中可能存在弱勢群體;
? 創新藥,之前的數據顯示了革命性的療效,期待可因藥物有效而提前終止的臨床試驗。
DMC由主席和一般成員組成,至少包含3名成員(含主席),DMC成員的選取應具有代表性、公正性、獨立性,同時與相關方無利益沖突。
? 代表性:DMC成員是來自于不同學科的專家,根據試驗的特殊需要邀請臨床專家、統計學專家、毒理學、流行病學、藥學或醫學倫理學等方面的專家來審閱研究中的試驗數據。
? 公正性:DMC中所有成員應均有相等的權利發表自己的看法,提出個人建議。注意,DMC 給出的建議最好通過達成內部共識而非簡單投票的方式。
? 獨立性:DMC成員不得在項目研究團隊中任職或擔任顧問,僅與申辦者保持必要的聯系。
? 利益沖突:DMC成員與臨床試驗相關方無財務利益、學術利益及其他利益沖突。
DMC主要依托于其特有的會議程序展開,按照會議類型分為DMC的啟動會、計劃的數據審核會和計劃外會議。
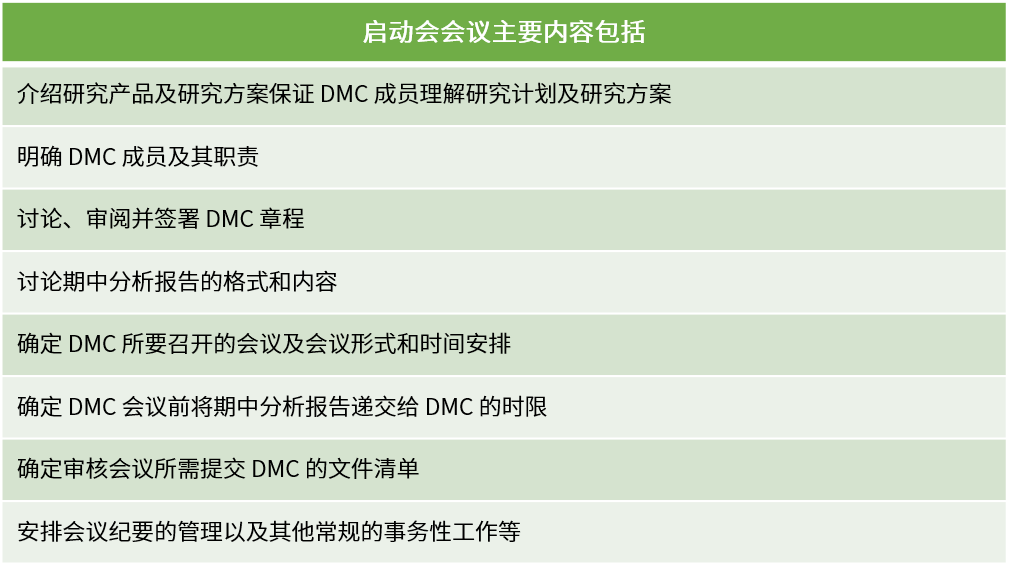
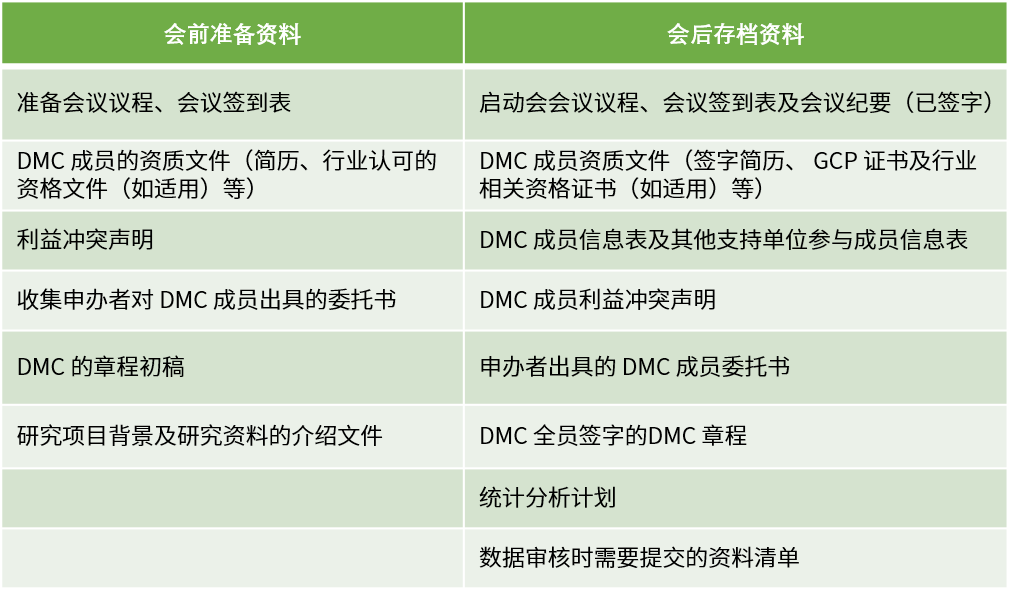
DMC啟動會應在首例受試者入組前召開,參會人員包含但不限于所有DMC成員、項目研究團隊和獨立統計團隊。
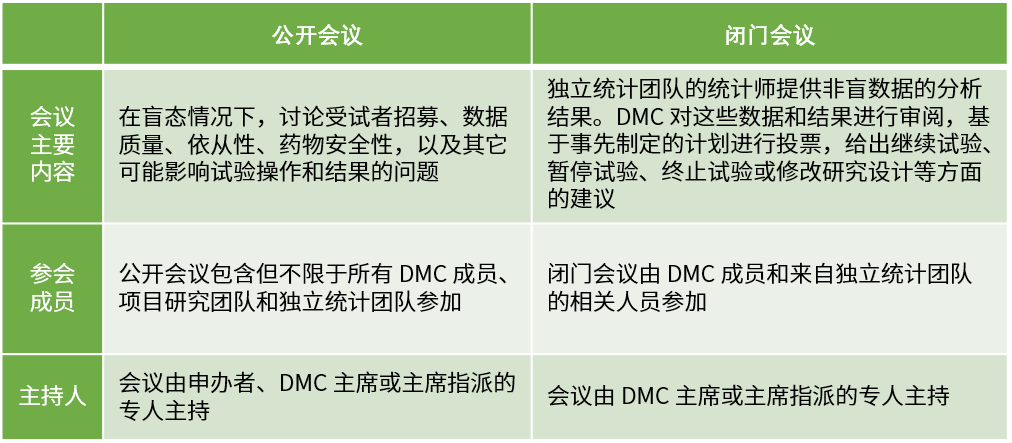
計劃會議需要按照根據DMC章程規定的頻率、形式開展,通常根據 DMC目的以及試驗預期入組率、事件發生率、隨訪期等執行情況而定。DMC會議分為公開會議和閉門會議兩種形式。
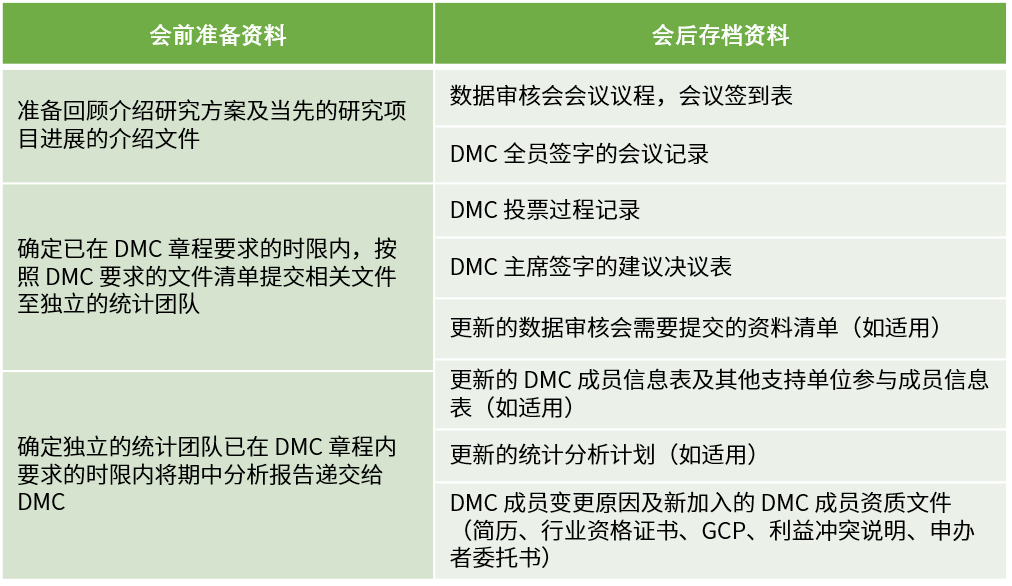
計劃外會議的準備、召開、存檔資料參考計劃會議的流程,會議紀要中需要詳述召開計劃會議的原因。召開計劃外會議的幾種情況如下:
? 基于計劃審核會議的分析結果,DMC 可要求舉行計劃外會議;
? 申報者發現緊急安全性問題;
? 其他申辦者或DMC認為必要的情況。
每次審核會議完成后 DMC 會根據會議過程中的決議給出專業建議,給出的建議基于安全性和有效性兩個方向,包括不限于:
? 無需修訂方案繼續試驗(按既定的研究方案實施) ;
? 修訂方案后繼續試驗(如調整樣本量等);
? 暫停入組直至解決不確定性問題(如潛在嚴重安全性問題) ;
? 終止試驗(如基于已觀測到的有效、無效或嚴重安全性問題) 。
當DMC因安全性問題而建議終止試驗時,申辦者需要及時與監管機構溝通。申辦者在實施DMC關于試驗設計重大修改的建議之前,應與監管機構進行討論,以確保這些變更符合法規要求。
DMC的建議對申辦者不具有約束力。如果申辦者不采納DMC關于因安全性問題終止試驗的建議,應以書面形式回復,并告知倫理委員會。
在新藥上市申請時,應在臨床總結報告中對DMC相關內容進行闡述,包括已召開的盲態和非盲態的、計劃內和計劃外的DMC會議相關內容。DMC會議紀要和會上審閱的報告應作為臨床總結報告的附件提交。申辦者在進行任何期中數據揭盲前(最好是在試驗開始前)向監管部門遞交DMC章程(包括期中分析計劃)。
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
