臨研必讀 | 臨床試驗現場核查相關流程及核查問題匯總
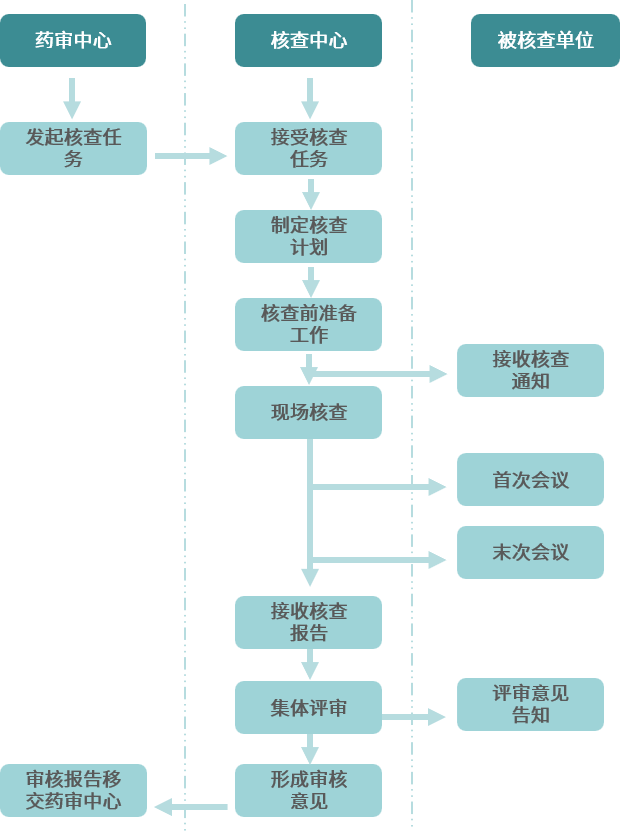
藥物臨床試驗現場核查工作流程
現場核查準備
申辦者首先應預估現場核查時間(平均核查7天,平均核查研究中心3-4個,根據項目情況(抽樣的風險因素,新中心、數據明現異常、安全性報告多等因素)制定),通知可能被核查單位、倫理、研究者等相關人員,再次梳理和熟悉臨床研究相關資料,查閱醫院HIS系統,準備PPT匯報。
研究中心接到通知,立即通知PI和主要參與人員,通知院領導、機構、倫理相關人員,通知相關委托方和協作方,PI/主要參與人員再次梳理和熟悉臨床研究相關資料,審閱PPT,熟悉潛在的問題及其回復,與相關科室協調,準備各項原始資料溯源,準備核查會議室及辦公用品。
-
再次審閱研究中心既往自查整改中的重要關鍵問題,討論并確定回答策略
-
相關研究者(含研究護士)、CRC以及指定的CRA務必提前熟悉相關問題和記錄文件
-
各流程負責人員,如知情同意簽署流程、藥物管理流程、生物樣本管理流程、每次訪視流程、溯源流程等,相關人員務必熟悉操作細節
-
根據GCP/項目/中心要求妥善保存好文件(研究者文件夾、受試者文件夾、原始病歷)
-
提前準備好核查組要求提供的文件(首次會議PPT+日程表、方案摘要、研究者分工授權表、鑒認代碼表、篩選入選表、PD列表、倫理文件夾)
-
其他文件:如問題說明文件、需要備份的信息文件(EDC數據備份等,備用,不主動提供)
-
HIS/LIS 溯源系統、影像科(OCT\FA\FP)溯源系統
-
溯源位置、溯源電腦、溯源賬號、溯源權限、參與溯源的研究人員/信息科人員、是否提前預約
現場核查過程
在核查過程中,熟悉臨床研究過程和資料的人員需全程陪同協助核查,對專家提出的問題及時溝通并反饋,監查員、申辦方相關人員需全程參加,主要研究者(PI)需在重要節點積極參與,包括核查首次會議、期間溝通討論會、總結會等。
以下匯總了部分主要核查問題:
涉及入排標準違背;受試者的檢查結果尚未全部出來就給受試者用藥;用藥未嚴格按照方案進行;受試者部分檢查時間超窗或遺漏;試驗過程中漏做某項檢查等。
受試者在其他醫院或科室就診開具非試驗藥物,或受試者發生了不良事件(AE)而開具非試驗用藥;受試者幫助其親屬開具藥物,本人并未使用;合并用藥的漏記常伴隨著AE漏報。
篩選日期早于知情同意的日期 (預篩選);受試者鑒認代碼表中信息不全(缺少受試者的身份證信息等);受試者未提供身份證復印件;知情同意書受試者與研究者簽字日期不一致。
藥物運輸、保存時無溫度記錄;藥物配送數量與使用、回收不一致;藥物存儲溫度無記錄人簽字;用藥記錄與受試者日記卡不一致;無受試者用藥日記卡;GCP處方上無核對者簽名或發藥人與核對者不一致。
受試者的檢查報告上缺少研究者的簽名和判斷;檢查時間先于知情同意時間;受試者部分檢查時間超窗或遺漏;妊娠檢查結果無法溯源(建議抽血檢查,若進行尿妊娠試驗,要有照片及相應的記錄)。
參考法規:
國家食品藥品監督管理總局關于發布藥物臨床試驗數據現場核查要點的公告(2015年第228號)
國家食品藥品監督管理總局藥物臨床試驗數據核查工作程序(暫行)
-END-



轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
