匯總 | 國內外藥品試驗數據保護制度(附國內外數據保護制度對比圖)
美國是最早對藥品試驗數據進行獨占保護的國家。在Hatch-Waxman法案出臺前,無論是新藥上市申請(NDA)還是仿制藥上市申請(ANDA),均必須向FDA提交臨床試驗數據。
1985年,Hatch-Waxman法案規定仿制藥企業在申請仿制藥上市時無需提交證明藥品安全性和有效性的試驗數據,只需要提交證明仿制藥與原研藥具有生物等效性的數據。
根據2004/27/EC號指令,歐盟目前對新藥采取“8+2+1”的保護模式,即新藥自獲準上市之日起10年內受數據獨占保護;在新藥獲準上市的前8年,藥監部門不受理仿制藥上市申請;在新藥獲準上市滿8年后,藥監部門可以受理仿制藥上市申請,但在保護期屆滿前2年不批準仿制藥上市;在8年“不受理”期間提出新適應癥,延長1年保護期。
1979年修訂的《藥事法》規定了藥品上市后的再審查制度。再審查制度是指新藥在獲得上市批準后的規定期限內,新藥企業需要提交藥品使用過程中的臨床數據,供藥監部門對新藥在使用過程中的安全性和有效性進行審核。
《藥事法》規定,藥品數據保護制度的運行操作與再審查制度同步,再審查期即藥品試驗數據保護期。在保護期內,藥監部門不受理仿制藥上市申請。當試驗數據保護期結束后,只需要審查仿制藥是否與新藥具有生物等效性即可
藥品數據保護期限:
含新化學成分藥品:8年
新醫療用配合劑或者新給藥途徑藥物:6年
罕見病用藥的:10年
新適應癥、新劑量藥物:4-6年
加拿大數據保護制度針對創新藥,具有新適應癥、新劑型的藥品補充申請則無法獲得保護。
創新藥獨占保護期為8年,采用“6+2”的保護模式,在獨占保護期的前6年,仿制藥企業不得提出上市申請,6年期滿后可申請仿制藥上市,但藥監部門在保護期屆滿后方可批準仿制藥上市。另外,創新藥品如能夠證明對兒童有治療效果,則可以額外獲得6個月的保護期。
我國藥品數據保護制度建立歷程:
· 對批準生產的新藥品種設立監測期。監測期自新藥批準生產之日起計算,最長不得超過5年。監測期內的新藥,國家食品藥品監督管理局不批準其他企業生產、改變劑型和進口。
· 對于已申請中藥品種保護的,自中藥品種保護申請受理之日起至作出行政決定期間,暫停受理同品種的仿制藥申請。
我國采用市場獨占的方式,根據藥物的創新程度以及臨床需求情況予以區分,創仿不能實現均衡發展。此外,目前的政策完全將專利鏈接制度與數據保護制度割裂開來,但二者有待銜接,如首仿專利挑戰,專利挑戰成功后即可批準上市,但原研藥品仍可能在數據保護期內。
相信隨著專利鏈接制度落地以及《藥品管理法實施條例》的修訂,我國的數據保護制度將會很快正式出臺實施。
國內外數據保護制度對比圖
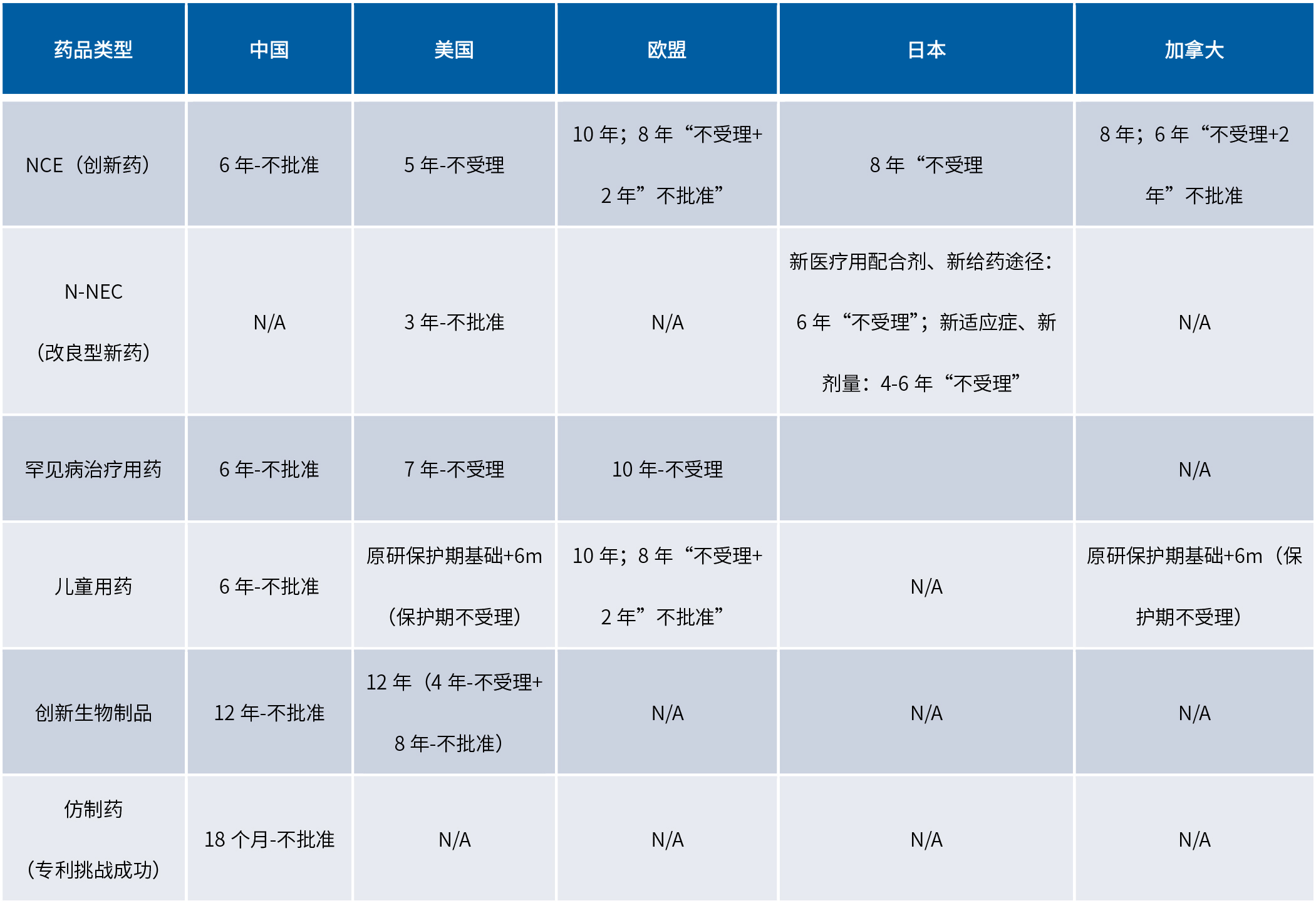
(點擊查看大圖)
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
