分享 | 臨床風險管理計劃撰寫
“臨床風險管理計劃(RMP)”是為了識別和描述重要的已識別風險、重要的潛在風險和重要的缺失信息,進而提出與風險相匹配的藥物警戒活動和風險管理措施,以確保適應癥人群在用藥過程中保持獲益大于風險。本文作者根據自身撰寫的 RMP,總結以下內容與各同行交流分享。
(一)安全性概述
按照《E2E:藥物警戒計劃》,安全性概述應當是“一個關于藥物重要的已識別風險,重要的潛在風險和重要的缺失信息的摘要”。簡而言之,撰寫安全性概述需要從“藥物的用途、藥物的風險、藥物的適用范圍”進行闡述。因此,又將安全性概述分為三部分:目標適應癥流行病學、重要的已識別/潛在風險、重要的缺失信息。
在對藥品進行風險識別時,適應癥的疾病特征和人群大小對風險是否影響獲益平衡的結論產生重要影響,因此需要首先對目標適應癥的流行病學信息進行總結。
檢索相關資料的主要方向,如:人群基本流行病學數據和特征、自然病程特征、人群重要的合并疾病及合并用藥以及目前可及的治療手段等相關信息的摘要。
實際撰寫時,可以考慮參考項目已有的資料與適應癥治療指南,同時也要進行文獻檢索,以獲取最新的信息。
風險,是不良反應,但不是所有的不良反應都是風險。RMP 應聚焦解決不良臨床結局,有足夠的科學證據證明是由藥物引起的風險。因此對重要風險的分析和評價變得尤為重要。
? 風險類別:重要風險被區分為“已識別”和“潛在”兩類風險。實際撰寫時,可以參考同類藥物的說明書及風險管理計劃,結合自己已有的臨床/非臨床數據進行分析。
? 風險名稱:建議盡量使用國際醫學用于詞典[MedDRA]術語,選擇更為貼切的風險名稱。
? 確定重要的已識別風險/重要的潛在風險:“安全性概述”部分的主體內容是對重要風險的分析和評價,無論針對的是何種適應癥和目標人群,在確定風險是否重要是,應該考慮以下因素:
(1)風險的醫學重要性;
(2)發生頻率、可預測性、可預防性和可逆性;
(3)對公眾健康的潛在因素。
通過上述內容,便于對風險的識別和確定,之后根據風險機制、非臨床數據以及臨床數據三方面進行論證。我在撰寫過程中更多關注的是臨床數據,參考同類藥物以及自己本身的數據。
? 重要的缺失信息:指對藥品某方面的安全性特征或某特定人群使用該藥品的風險獲益信息存在缺失,且這些缺失的信息是臨床所關注的。
實際撰寫過程中,需要對列為缺失信息的數據進行論證說明,說明作為缺失數據的原因、對被超適應癥使用的可能性進行評估。
(二)藥物警戒活動
藥物警戒活動的目的是進一步描述和量化風險特征、確認或消除潛在風險、識別新的風險、收集缺失信息領域的信息以及評估風險控制措施的有效性。藥物警戒活動計劃包括常規藥物警戒活動和額外藥物警戒活動。
常規藥物警戒活動是所有藥品必須進行的主要/最低限度的藥物警戒活動組合。申請人應遵從法規要求計劃并實施活動,包括:建立收集、報告不良反應的系統和程序;向監管部門報告藥物的不良反應;DSUR/PSUR的遞交;持續性監測收集安全信號;更新說明書以及藥品監管機構規定的其他要求等。
額外的藥物警戒活動是非臨床研究或以安全性為目的臨床試驗和/或非干預性研究等。申請人應該對每項額外的藥物警戒活動的目的和必要性進行說明。如需開展,建議以活動類型為中心撰寫相關內容,而不是以風險為中心進行撰寫。
風險控制措施是以安全性概述為基礎,制定與藥物風險相匹配的風險控制措施,目的在于預防/降低重要風險的發生。風險控制措施包括常規風險控制措施和特殊風險控制措施。
01、常規風險控制措施:常規風險控制措施適用于所有藥品,包括修訂藥品說明書、標簽、包裝,采用適當的藥品處方形勢和管理狀態等。
在撰寫常規風險管理措施時,根據安全性信息中所確定的風險/缺失信息進行制定,一般常見于自擬說明書/可預防性中,如說明書中用法用量、禁忌、警告、注意事項、不良反應等章節。
02、特殊風險控制措施
特殊風險控制措施通常包括風險溝通、教育計劃、患者日記、處方限制項目、受控分銷、疾病/藥物登記招募計劃、避孕計劃等。只有當常規風險控制措施無法達到預期效果時才實施特殊風險控制措施。
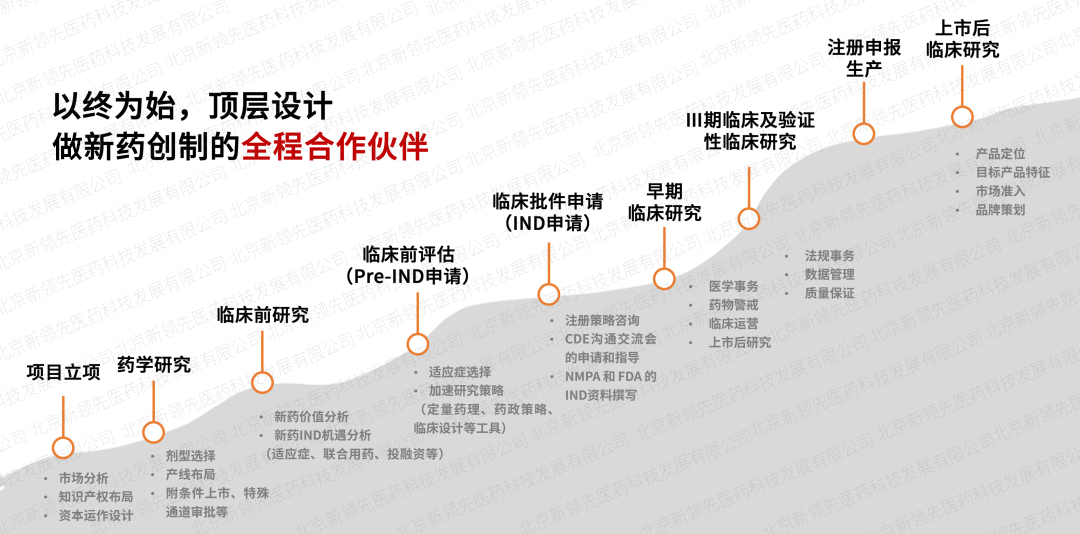
深藍海生物醫藥是新領先在臨床CRO領域的子品牌,成立于2007年,目前已擁有高專業水準的臨床服務團隊600余人,已為300余家國內外知名企業提供多元化的研發支持臨床技術服務,項目全面覆蓋生物藥、化藥、中藥、醫療器械、細胞與基因治療等藥物,滿足不同研發型企業的臨床研究定制需求,為國內外客戶打通新藥上市前關鍵瓶頸。通過16年經驗積累,深藍海生物醫藥已經完成臨床研究500余項,每年開展Ⅰ類創新藥研究10-20項,率先開展醫美、特醫食品、細胞與基因治療藥物等領域研究,填補國內外多項空白。
依托于新領先CXO服務體系,創建了“交互式”臨床服務模式,在項目立項階段全面介入,做新藥創制的全程合作伙伴,整合醫學、藥政、藥學研發等技術專家進行頂層設計,最大限度降低項目研發風險。同時,成立專項政府引導基金,為創新項目提供不同階段的投融資,最大程度加速藥品上市進程。此外,強大的定量藥理學及體內外橋接團隊針對特定疾病和特定人群進行數字模型研究,制定科學高質的臨床研究方案,提高新藥臨床開發效率。
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
