匯總 | IND申報流程中美對比(附詳細流程圖)
企業(yè)需要向美國食品藥品監(jiān)督管理局(FDA)提交 IND 申請。一般來說,化藥的新藥臨床申請被稱為IND、生產(chǎn)申請被稱為NDA,仿制藥生產(chǎn)申請稱為ANDA,而生物藥的申請則被稱為BLA(Biologics license applicatio)。
企業(yè)需要向國家藥品監(jiān)督管理局(NMPA)提交申請,申請類型通過受理號加以區(qū)分。
-
第一位:C表示國產(chǎn),J表示進口
-
第二位:X表示新藥,Y表示已有國家標準(即仿制藥)
-
第三位:H表示化學藥品,Z表示中藥,S表示生物制品,F(xiàn)表示輔料
-
第四位:L表示申請臨床,S表示申請上市(即生產(chǎn)),B表示補充申請,Z表示再注冊,F(xiàn)表示分包裝,R表示復審
申報詳細流程圖
美國:
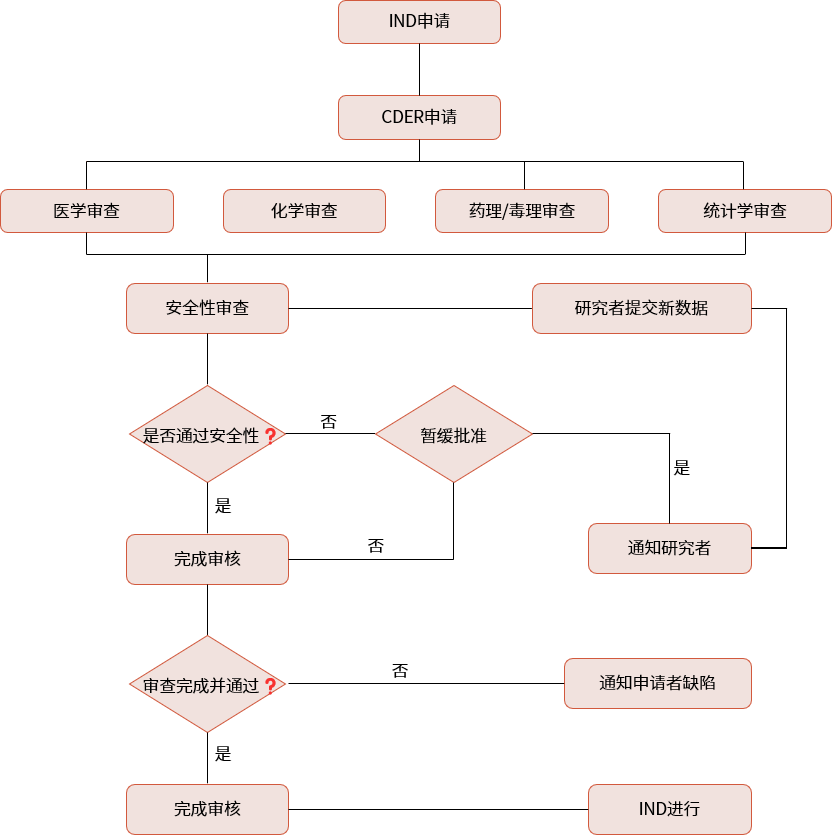
▲ IND申報流程
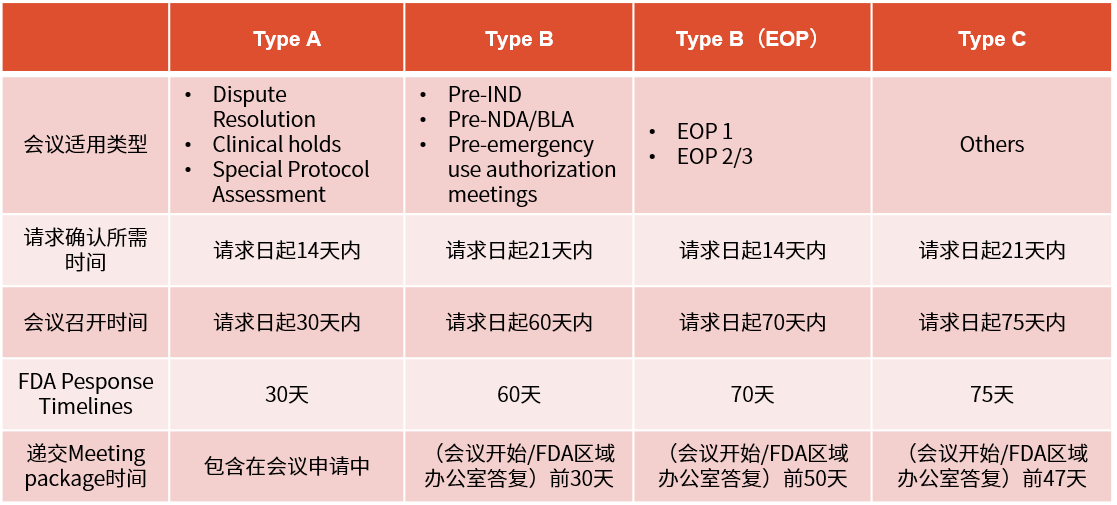
▲ 臨床試驗申請前會議(pre-IND會議)要求及時限
中國:
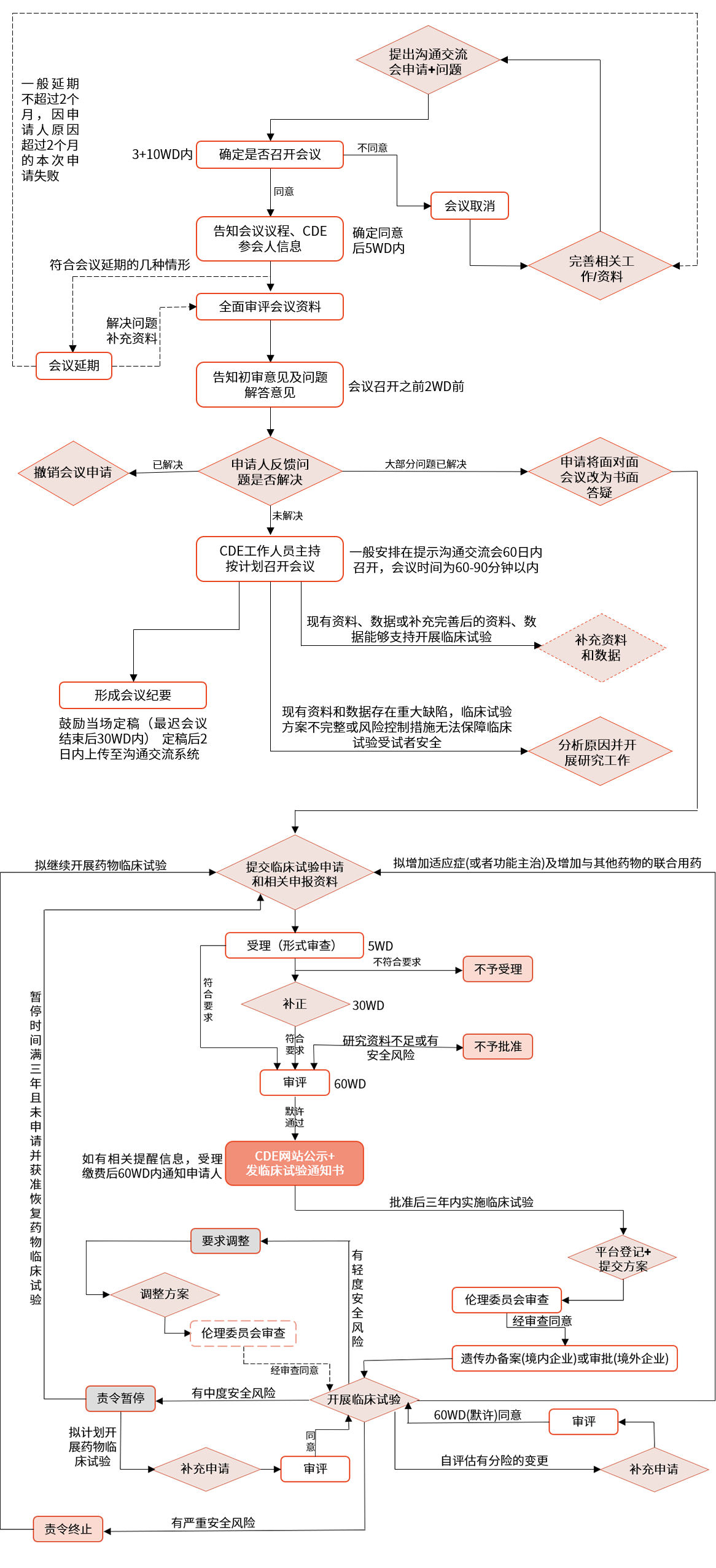
▲ pre-IND溝通交流會、藥物臨床試驗申請流程圖
中美申報對比
? 整體架構(gòu)
-
美國:美國FDA下設有藥品評估和研究中心(CDER,Center for Drug Evaluation and Research),CDER下設多個辦公室,審評以治療領域來劃分。
-
中國:NMPA下設藥品評審中心(CDE,Center for Drug Evaluation),CDE下設多個審評處,如化學藥審評一處、化學藥審評二處、生物制品審評處等。這些審評處分別負責不同類型藥品的審評工作。
FDA的審評部門是以治療領域來劃分的。NMPA則是根據(jù)審評功能劃分,包括中藥、化學藥、生物制品、藥理毒理,這是二者在整體構(gòu)架上的不同。
? 溝通交流會
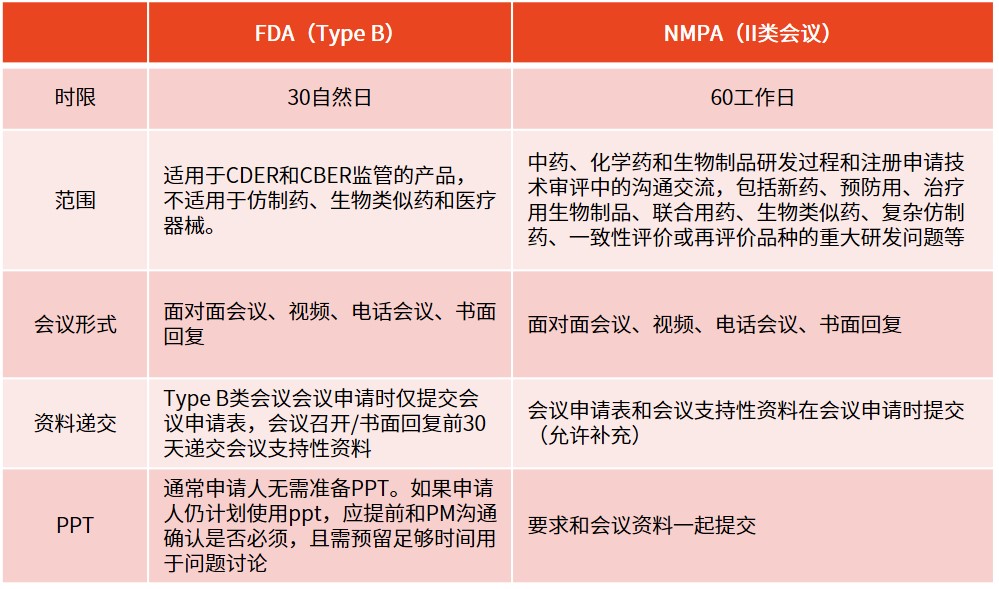
※ Pre-IND的重要性(成本、監(jiān)管機構(gòu)關系)除了會前準備、會議本身及其后續(xù)的溝通成本(包括記錄會議內(nèi)容和回應或澄清機構(gòu)的問題)外,pre-IND會議不會給申請人帶來額外費用。通過避免無謂的研究,并盡早確保與監(jiān)管機構(gòu)的策略保持一致,申請人能更快推進產(chǎn)品上市,這相當于減少了項目成本。同時,申請人本身也希望通過減少成本來盡可能減少投資者融資的輪次,因為這通常伴隨著各種條件。
最重要的是,pre-IND會議為申請人和監(jiān)管機構(gòu)的項目經(jīng)理提供了一個相互了解、打好合作基礎的機會。這樣的會議還特別有助于申請人向監(jiān)管機構(gòu)介紹那些從未在人體中進行過測試的新分子實體(NME),為雙方后續(xù)的合作打下了堅實的基礎。
? 審評過程
-
美國:企業(yè)需要在臨床試驗前向FDA提交IND申請。FDA有30天的時間對申請進行評估。在30天內(nèi),F(xiàn)DA會決定是否批準臨床試驗或者要求額外信息。如果30天內(nèi)未收到FDA的異議,則可視為默許,企業(yè)可開始臨床試驗。對于IND申請,F(xiàn)DA不收取審評費用。(與之相對的是上市申請300多萬美元的審評費用)
-
中國:企業(yè)需要向 NMPA 提交臨床試驗申請,經(jīng)過專家評審后,獲得批準或默示許可后才能進行臨床試驗。臨床審評收取一定費用。
-END-



轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應在授權(quán)范圍內(nèi)使用,并注明“來源:新領先醫(yī)藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
