政策法規(guī) || 《阿爾茨海默病治療藥物臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》(附法規(guī)概覽09.23-09.30)
01
關(guān)于公開征求《存在未滿足臨床需求的嚴(yán)重細(xì)菌性疾病患者抗菌藥物臨床研發(fā)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知
耐藥菌感染是全球關(guān)注的重要公共衛(wèi)生問題。細(xì)菌耐藥問題導(dǎo)致嚴(yán)重細(xì)菌感染性疾病患者發(fā)病率逐年增加且缺乏有效治療手段。對(duì)于治療選擇有限或缺乏的存在未滿足臨床需求的患者,迫切需要新的、有效且安全的抗菌藥物。該類患者病情重、早期病原學(xué)診斷困難、常需要多種抗菌藥物聯(lián)合使用等,使嚴(yán)重細(xì)菌性疾病患者抗菌藥物臨床試驗(yàn)的設(shè)計(jì)、開展以及研究結(jié)果的評(píng)估面臨巨大挑戰(zhàn)。為滿足此類抗菌藥物創(chuàng)新研發(fā)的需要,藥品審評(píng)中心起草了《存在未滿足臨床需求的嚴(yán)重細(xì)菌性疾病患者抗菌藥物臨床研發(fā)技術(shù)指導(dǎo)原則》,現(xiàn)形成征求意見稿。

掃描圖中二維碼
查看詳細(xì)信息

02
關(guān)于公開征求《阿爾茨海默病治療藥物臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知
阿爾茨海默病屬于重大公共衛(wèi)生領(lǐng)域疾病,是創(chuàng)新藥物研發(fā)的熱點(diǎn)和難點(diǎn)。為給業(yè)界人員在臨床研發(fā)路徑和臨床試驗(yàn)設(shè)計(jì)方面提供參考,提高臨床研發(fā)效率,藥品審評(píng)中心起草了《阿爾茨海默病治療藥物臨床試驗(yàn)技術(shù)指導(dǎo)原則》,已形成征求意見稿。

掃描圖中二維碼
查看詳細(xì)信息

01
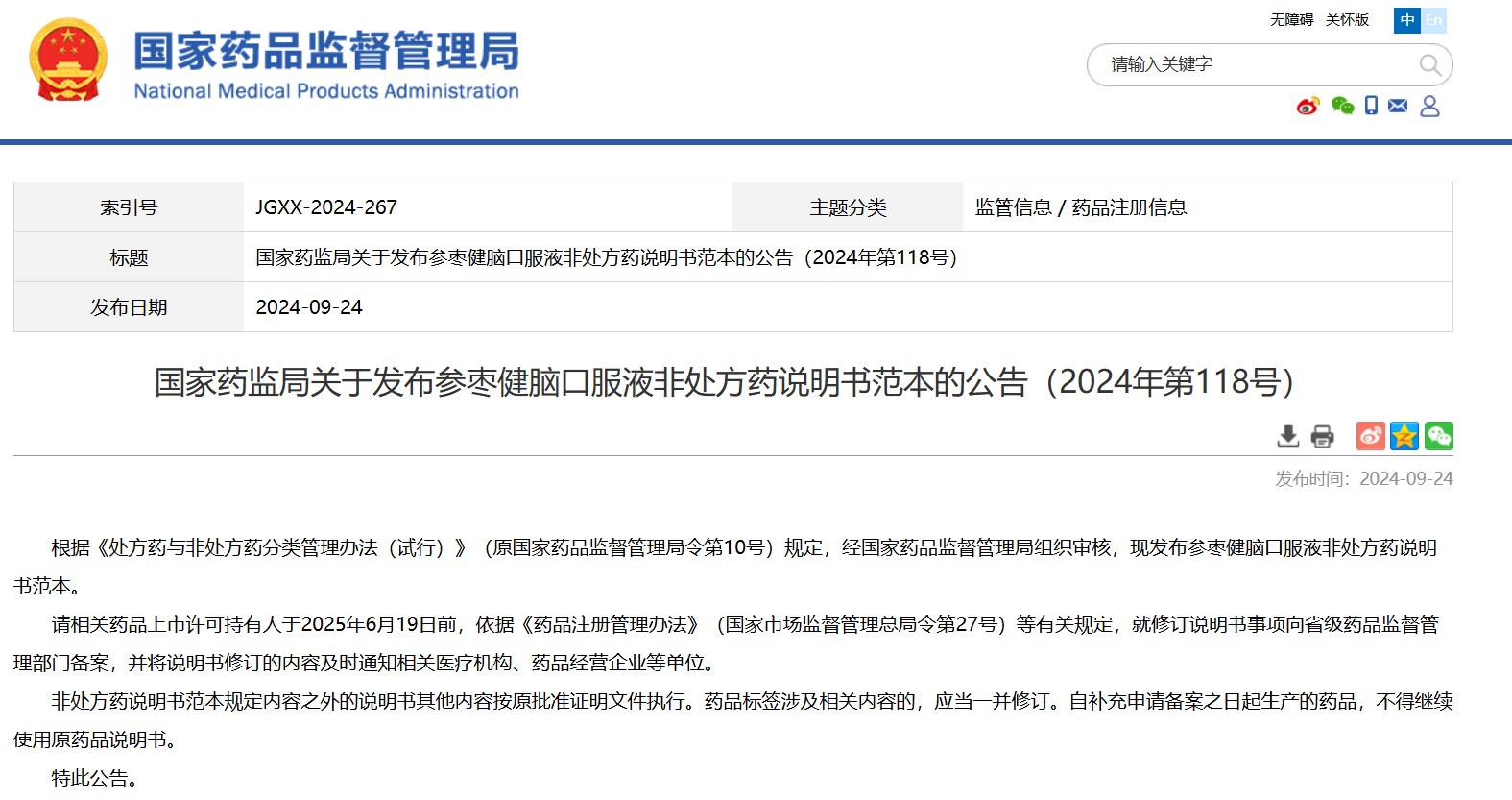
國(guó)家藥監(jiān)局關(guān)于發(fā)布參棗健腦口服液非處方藥說明書范本的公告(2024年第118號(hào))
掃描圖中二維碼
查看詳細(xì)信息

02
國(guó)家藥監(jiān)局關(guān)于中藥保護(hù)品種的公告(延長(zhǎng)保護(hù)期第17號(hào)) (2024年第116號(hào))

掃描圖中二維碼
查看詳細(xì)信息

03
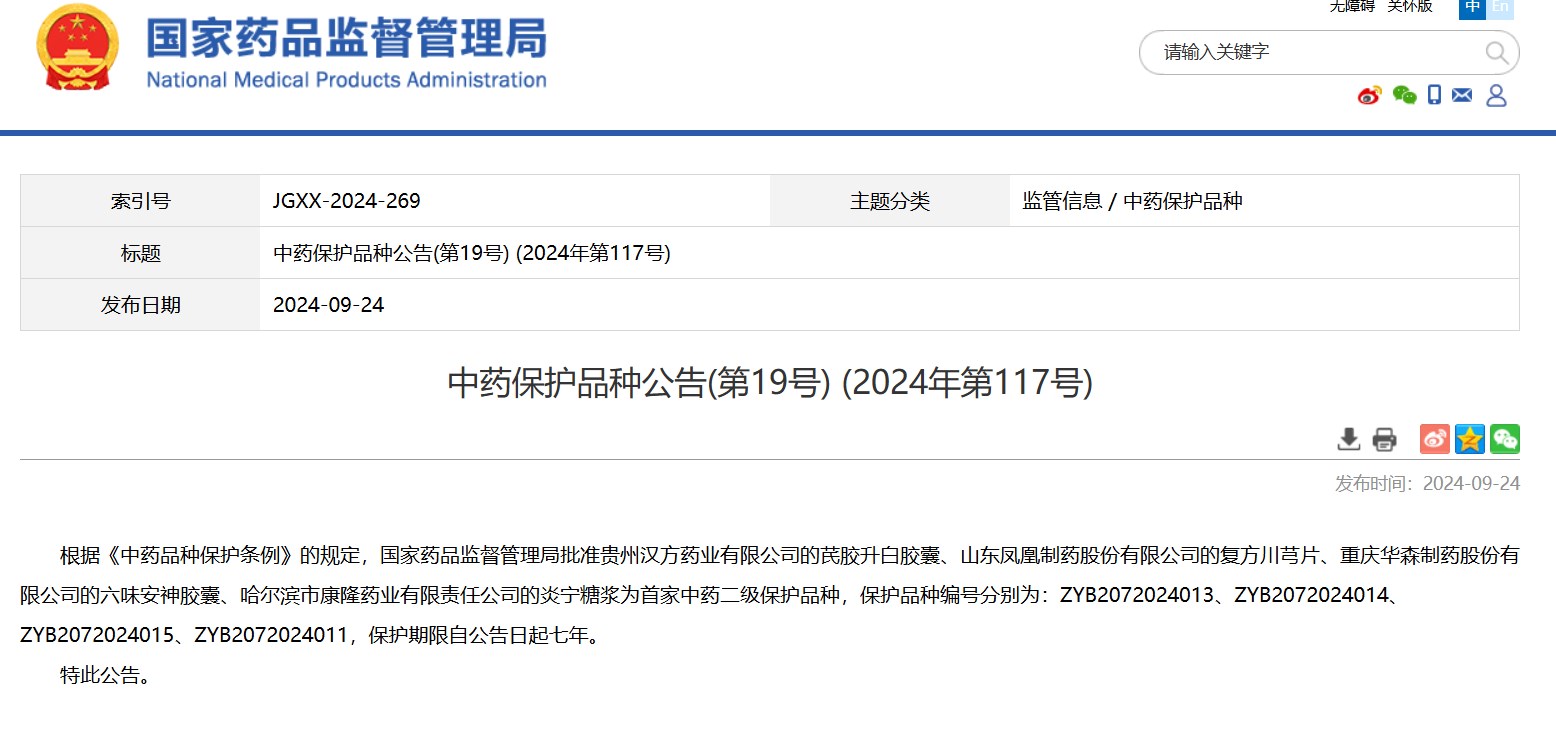
中藥保護(hù)品種公告(第19號(hào)) (2024年第117號(hào))
掃描圖中二維碼
查看詳細(xì)信息

04
2024年09月26日中藥品種保護(hù)受理公示

掃描圖中二維碼
查看詳細(xì)信息

CDE
01
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《地屈孕酮片生物等效性研究技術(shù)指導(dǎo)原則》《復(fù)方甘草酸苷片生物等效性研究技術(shù)指導(dǎo)原則》2項(xiàng)技術(shù)指導(dǎo)原則的通告(2024年第40號(hào))

掃描圖中二維碼
查看詳細(xì)信息

02
關(guān)于公開征求《地中海貧血基因治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細(xì)信息

03
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《疫苗免疫原性橋接臨床試驗(yàn)技術(shù)指導(dǎo)原則(試行)》的通告(2024年第41號(hào))

掃描圖中二維碼
查看詳細(xì)信息

04
關(guān)于公開征求《地拉羅司分散片生物等效性研究技術(shù)指導(dǎo)原則(征求意見稿)》等5個(gè)生物等效性指導(dǎo)原則意見的通知

掃描圖中二維碼
查看詳細(xì)信息

05
關(guān)于公開征求《生物類似藥說明書撰寫技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細(xì)信息

ADR
01
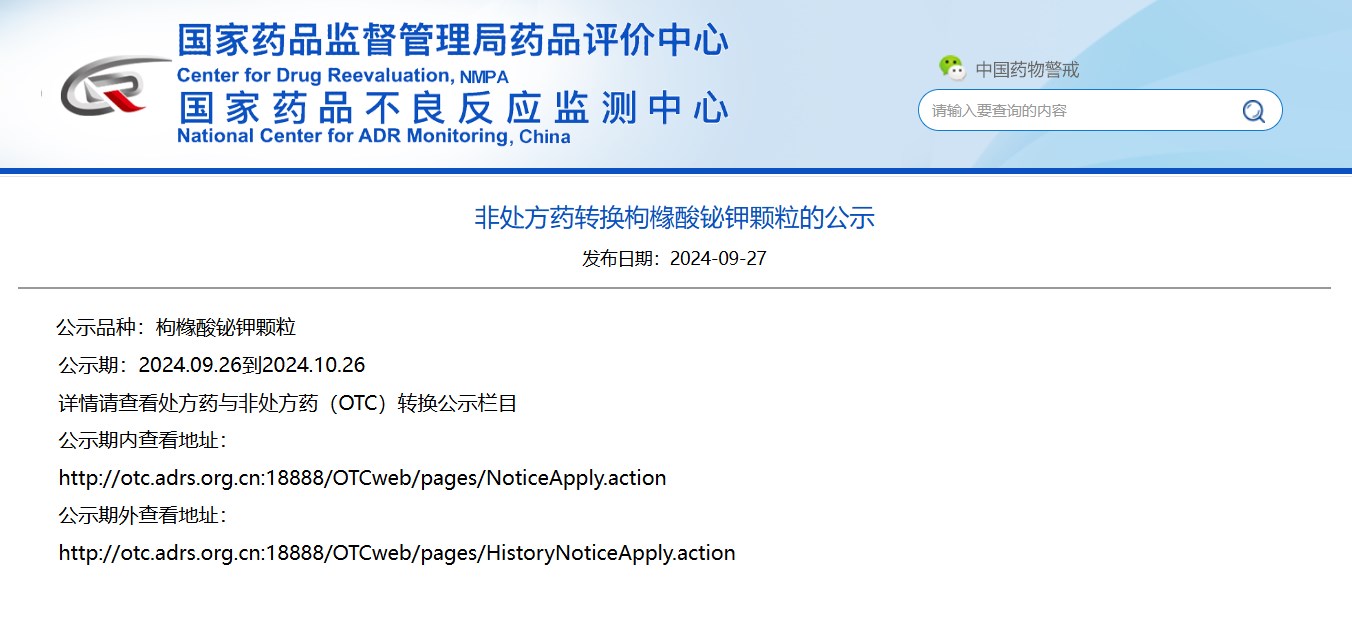
非處方藥轉(zhuǎn)換枸櫞酸鉍鉀顆粒的公示
掃描圖中二維碼
查看詳細(xì)信息

02
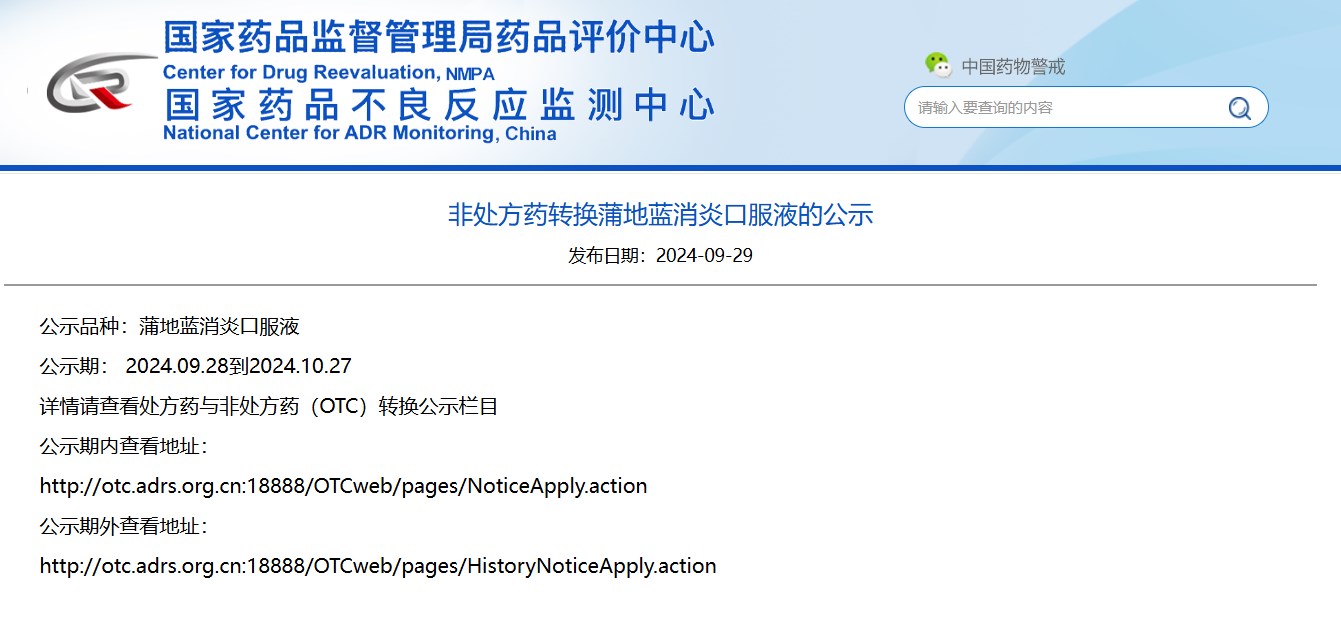
非處方藥轉(zhuǎn)換蒲地藍(lán)消炎口服液的公示
掃描圖中二維碼
查看詳細(xì)信息

藥典委
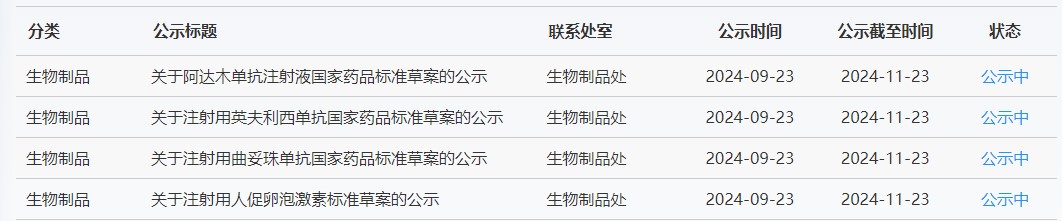
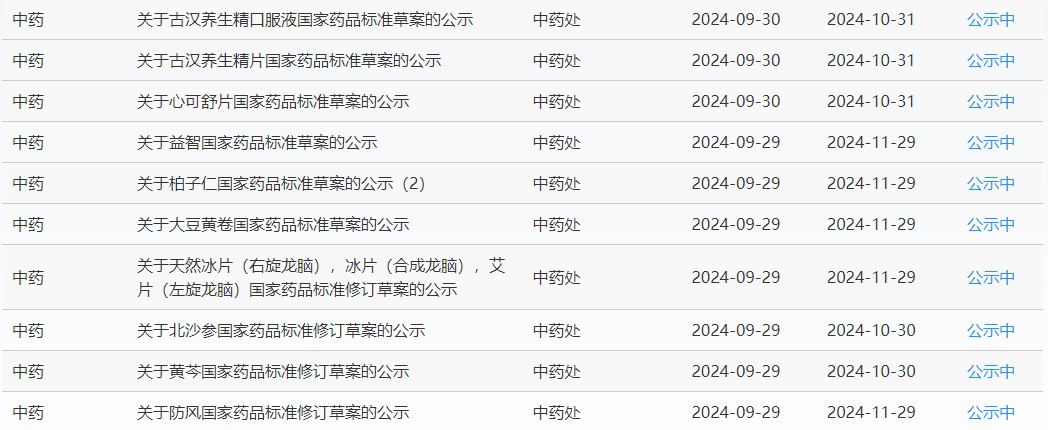
近期,藥典委發(fā)布的標(biāo)準(zhǔn)草案公示如下:



-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
