政策法規(guī) || 《化學藥生物等效性試驗備案范圍和程序(征求意見稿)》(附法規(guī)概覽10.21-11.01)
01
關(guān)于公開征求《化學藥生物等效性試驗備案范圍和程序(征求意見稿)》意見的通知
為優(yōu)化生物等效性試驗(BE)備案有關(guān)工作,明確BE試驗備案范圍,完善BE備案工作程序,經(jīng)廣泛調(diào)研和討論,我中心組織更新了《化學藥生物等效性試驗備案范圍和程序》,現(xiàn)形成征求意見稿。

掃描圖中二維碼
查看詳細信息

02
關(guān)于公開征求《口服藥物胃pH依賴性藥物相互作用評價技術(shù)指導原則(征求意見稿)》意見的通知國家藥監(jiān)局
為指導在口服藥物研發(fā)過程中評估與抑制胃酸藥物合用的pH依賴性藥物相互作用風險,提高研發(fā)效率,我中心組織起草了《口服藥物胃pH依賴性藥物相互作用評價技術(shù)指導原則(征求意見稿)》,現(xiàn)公開征求意見。

掃描圖中二維碼
查看詳細信息

03
關(guān)于發(fā)布仿制藥參比制劑目錄(第八十四批)及調(diào)出參比制劑目錄品種清單(第一批)的通告(2024年第46號)
經(jīng)國家藥品監(jiān)督管理局仿制藥質(zhì)量和療效一致性評價專家委員會審核確定,現(xiàn)發(fā)布仿制藥參比制劑目錄(第八十四批)及調(diào)出參比制劑目錄品種清單(第一批)。

掃描圖中二維碼
查看詳細信息

01
國家藥監(jiān)局藥審中心關(guān)于發(fā)布《氟[18F]化鈉注射液仿制藥藥學研究技術(shù)要求(試行)》的通告(2024年第44號)

掃描圖中二維碼
查看詳細信息

02
國家藥監(jiān)局藥審中心關(guān)于發(fā)布《已上市境外生產(chǎn)藥品轉(zhuǎn)移至境內(nèi)生產(chǎn)的藥品上市注冊申請申報資料要求(預防用生物制品)》的通告(2024年第43號)

掃描圖中二維碼
查看詳細信息

03
關(guān)于對創(chuàng)新藥以及經(jīng)溝通交流確認可納入優(yōu)先審評審批程序和附條件批準程序的品種開展受理靠前服務的通知

掃描圖中二維碼
查看詳細信息

04
關(guān)于將羥鈷胺注射液納入《以患者為中心的罕見疾病藥物研發(fā)試點工作計劃(“關(guān)愛計劃”)》試點項目的公示

掃描圖中二維碼
查看詳細信息

05
關(guān)于將Marstacimab納入《以患者為中心的罕見疾病藥物研發(fā)試點工作計劃(“關(guān)愛計劃”)》試點項目的通知
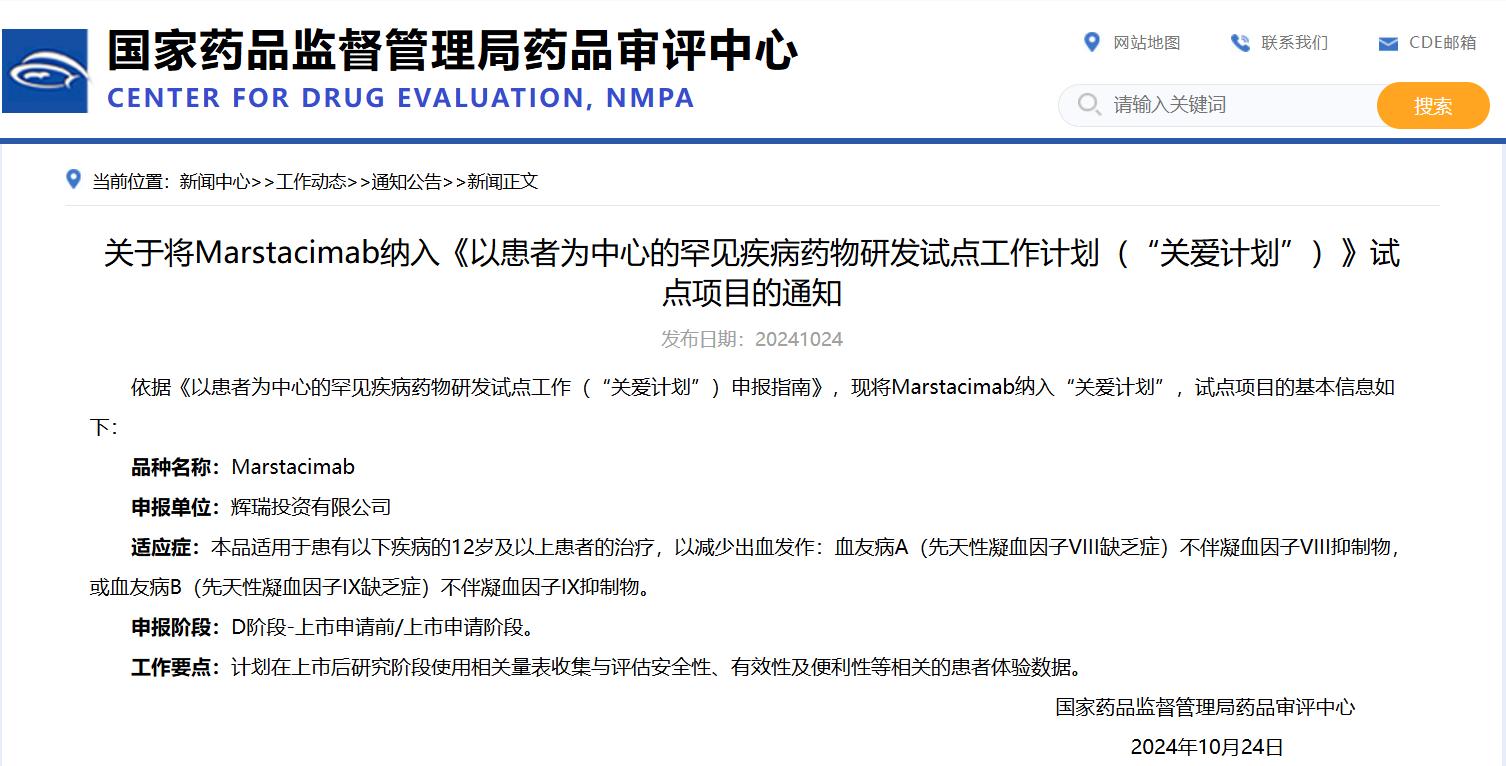
掃描圖中二維碼
查看詳細信息

06
關(guān)于將Fitusiran 注射液納入《以患者為中心的罕見疾病藥物研發(fā)試點工作計劃(“關(guān)愛計劃”)》試點項目的公示

掃描圖中二維碼
查看詳細信息

07
關(guān)于公開征求《中藥復方制劑新藥研發(fā)人用經(jīng)驗信息收集整理技術(shù)指導原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細信息

08
關(guān)于公開征求《藥物濃度-QTc臨床研究技術(shù)指導原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細信息

09
關(guān)于公開征求《抗體偶聯(lián)藥物臨床藥理學研究技術(shù)指導原則(征求意見稿)》意見的通知

掃描圖中二維碼
查看詳細信息

10
國家藥監(jiān)局藥審中心關(guān)于發(fā)布《可復制型慢病毒檢測共性問題與技術(shù)要求》的通告(2024年第45號)

掃描圖中二維碼
查看詳細信息

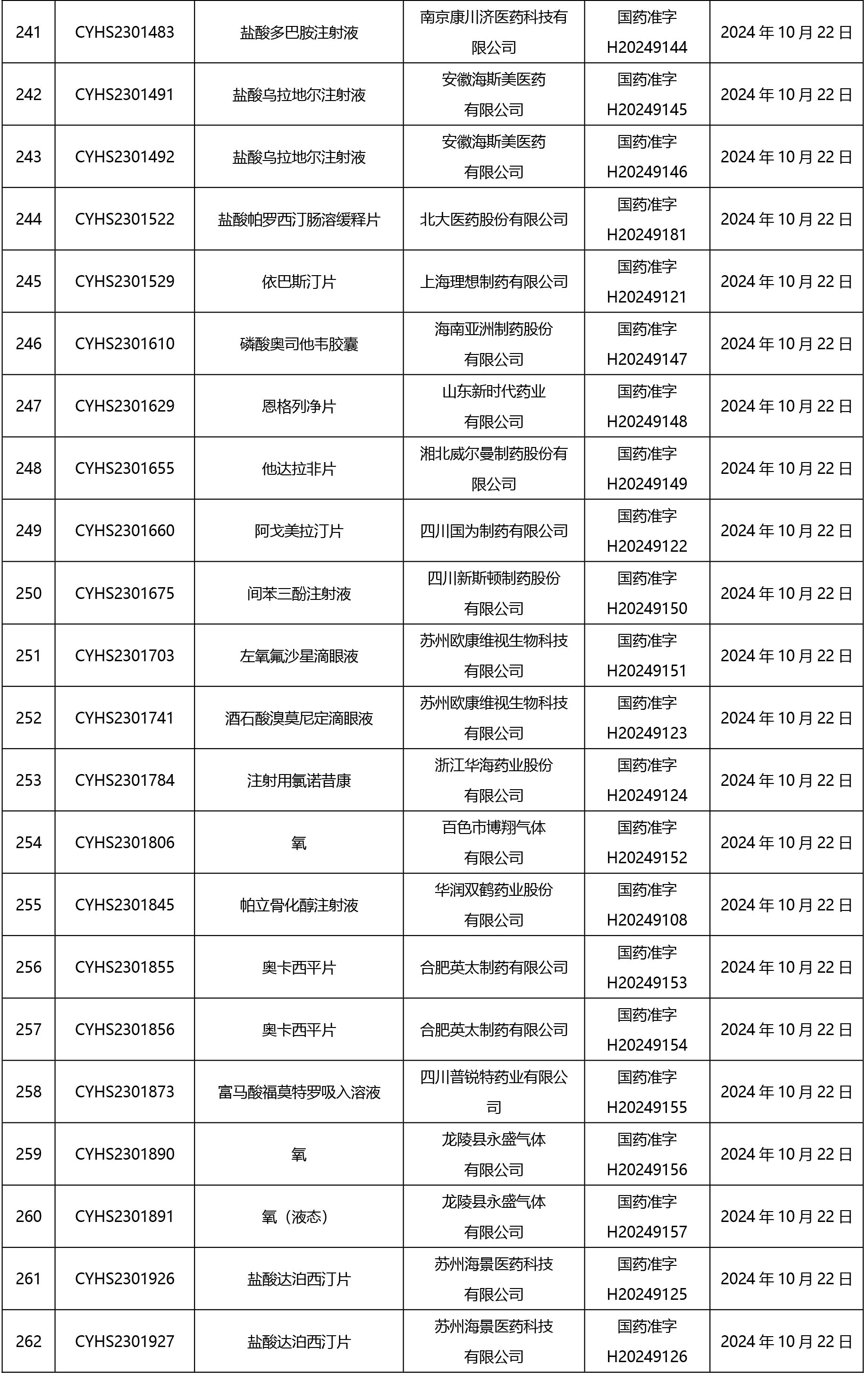
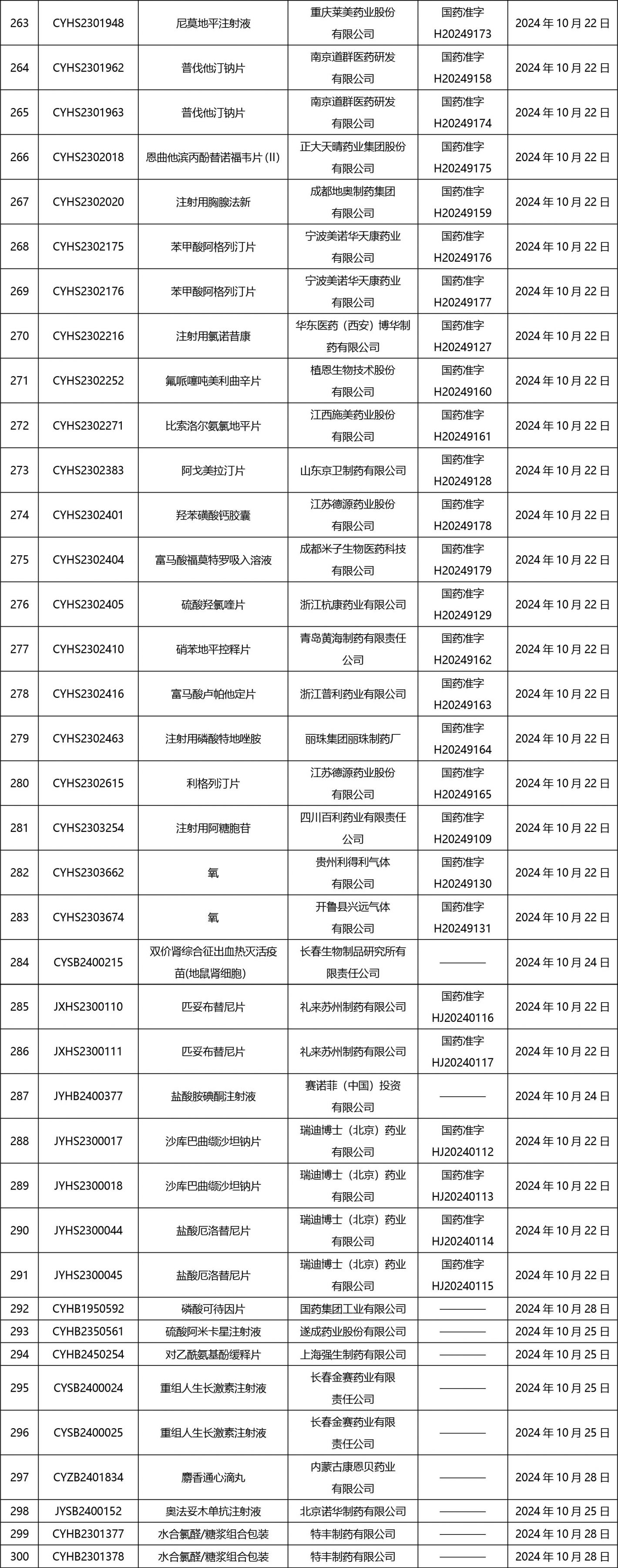
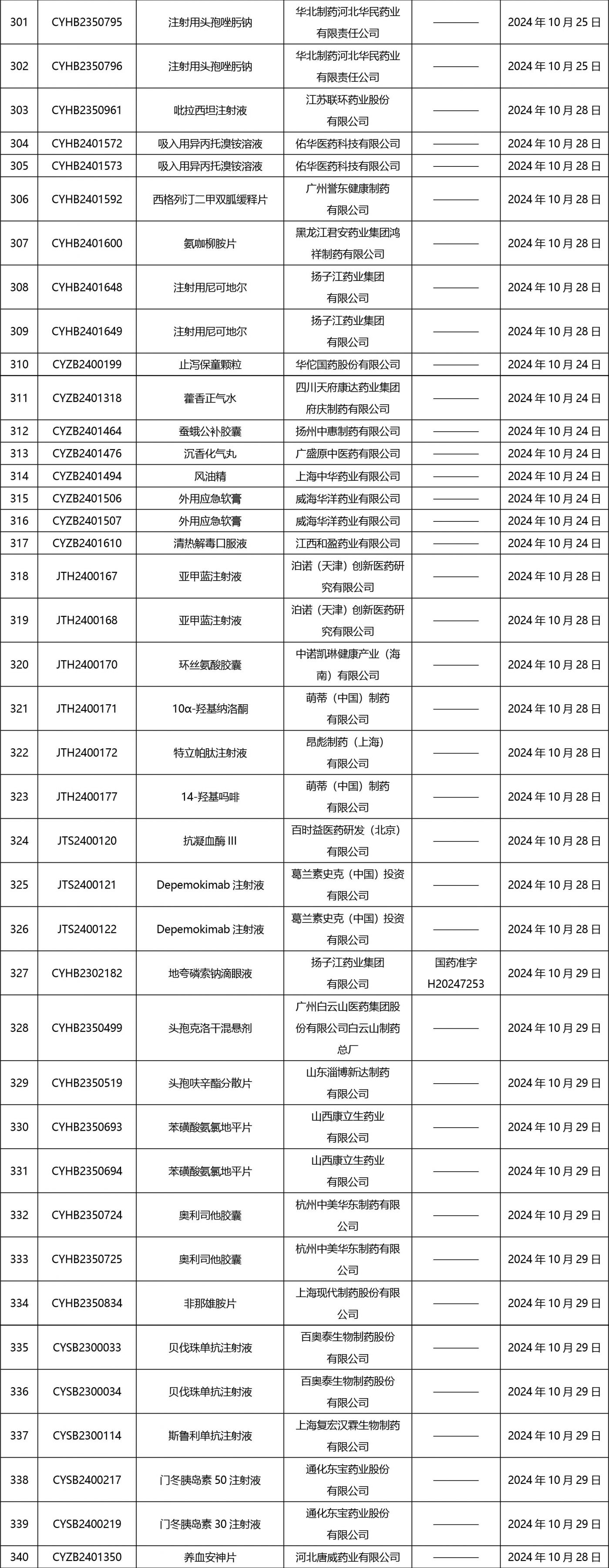
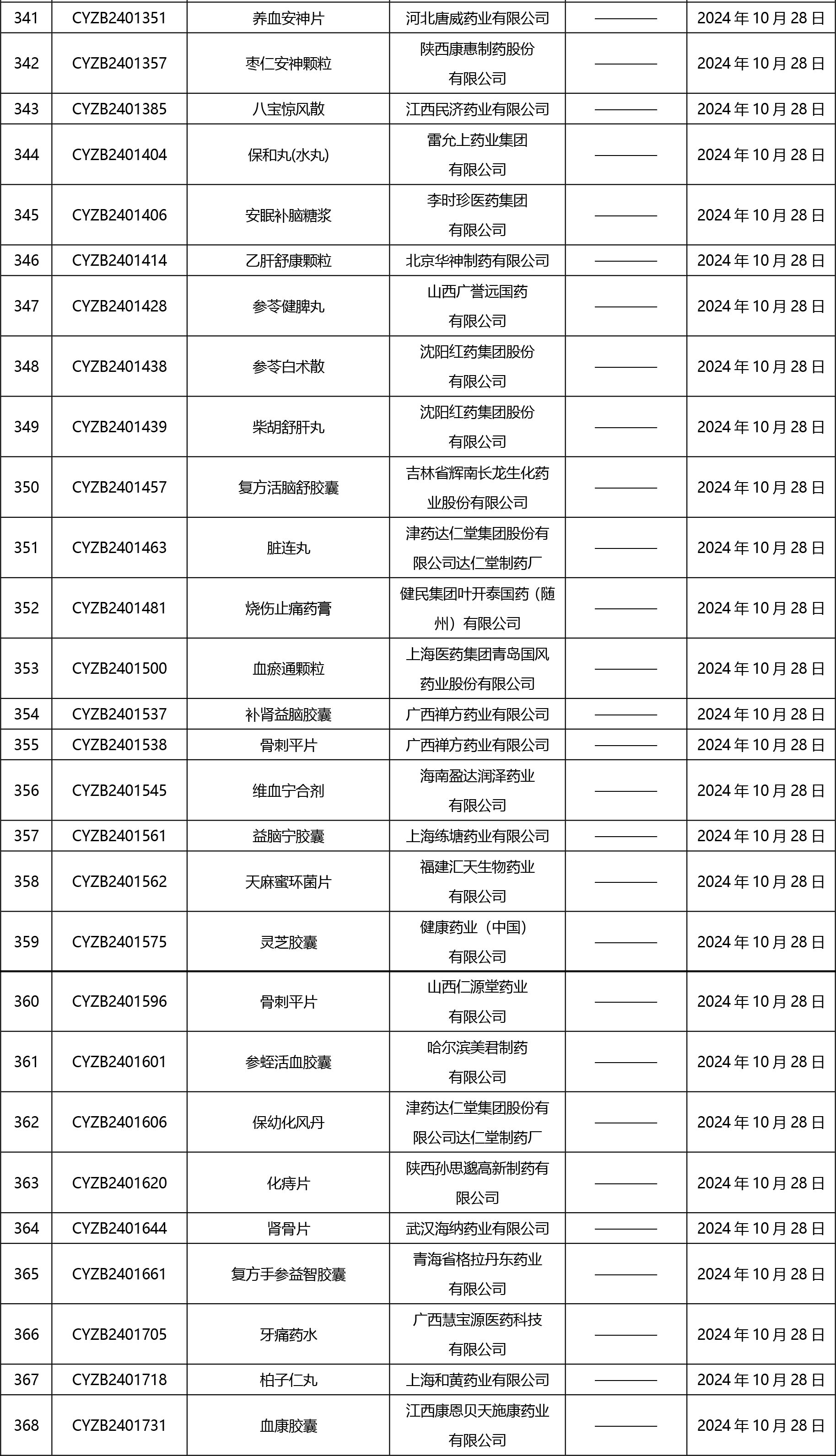
2024年10月21日至2024年11月1日 16:00發(fā)布368個待領(lǐng)取藥品批準證明文件,其中注射液125個,一致性評價品種45個。
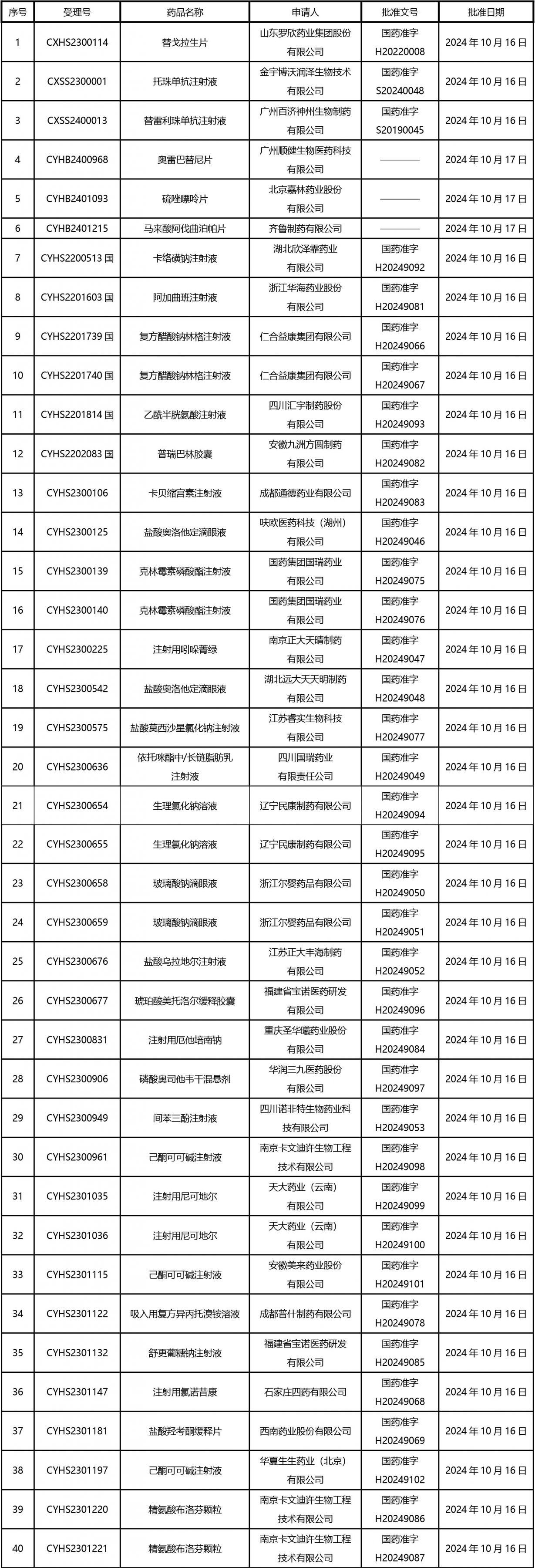
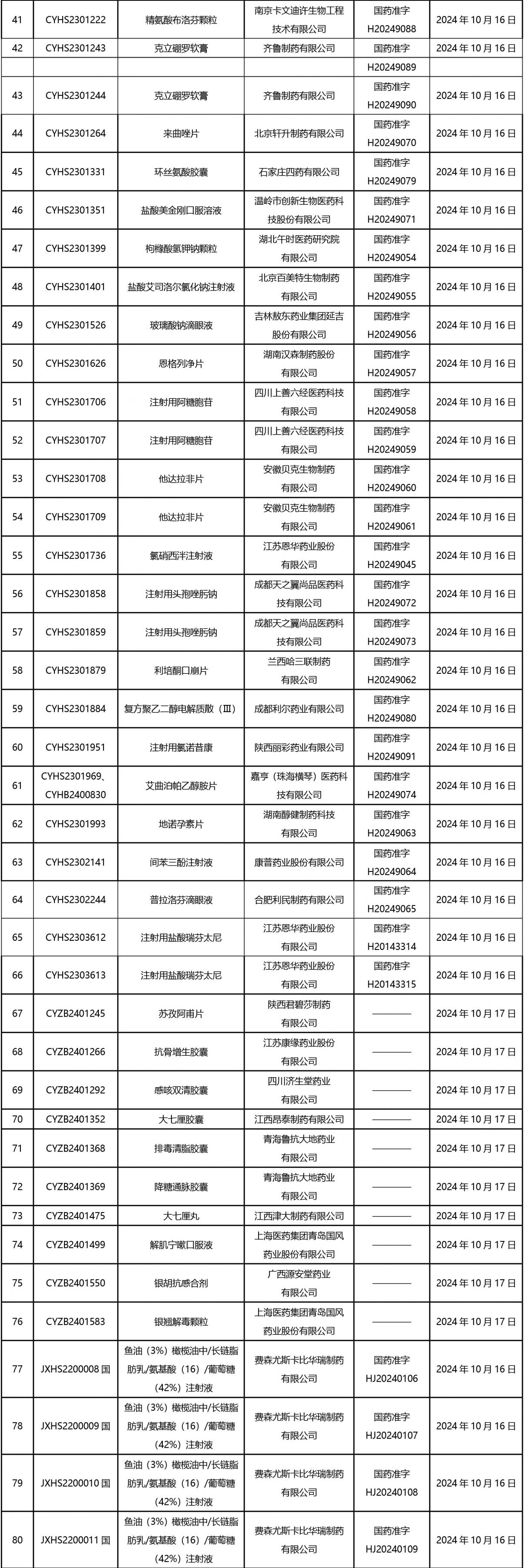
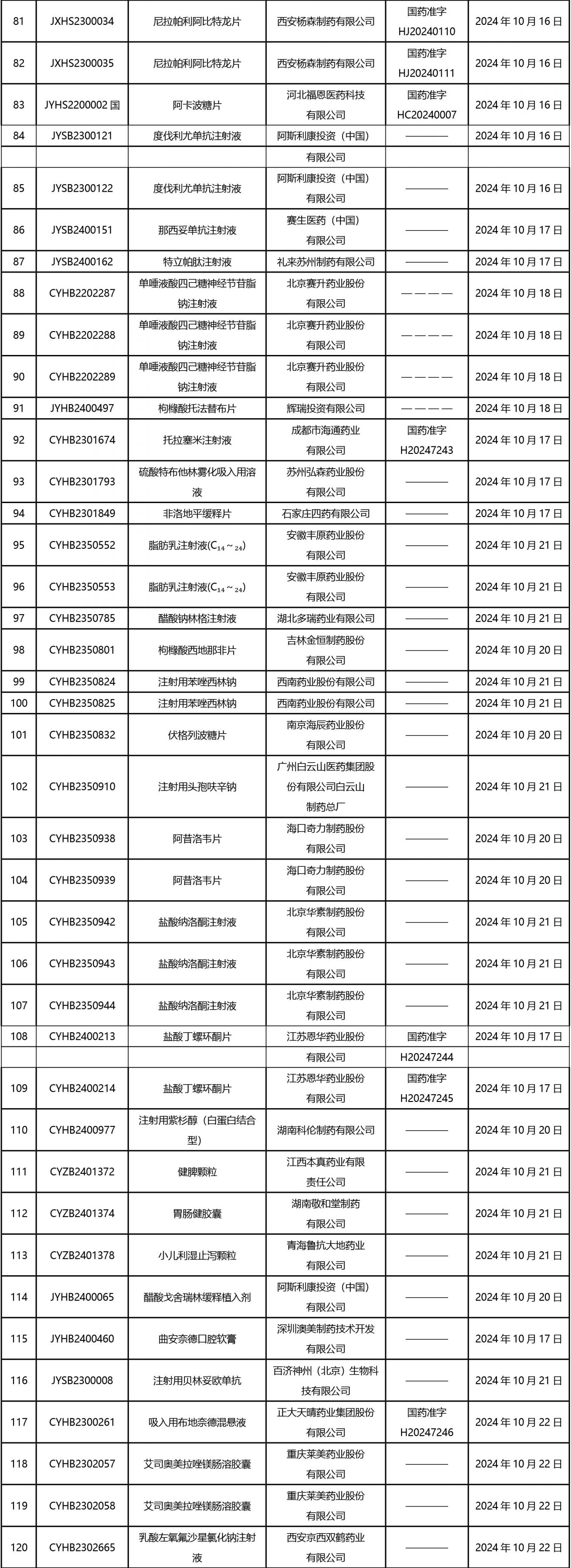



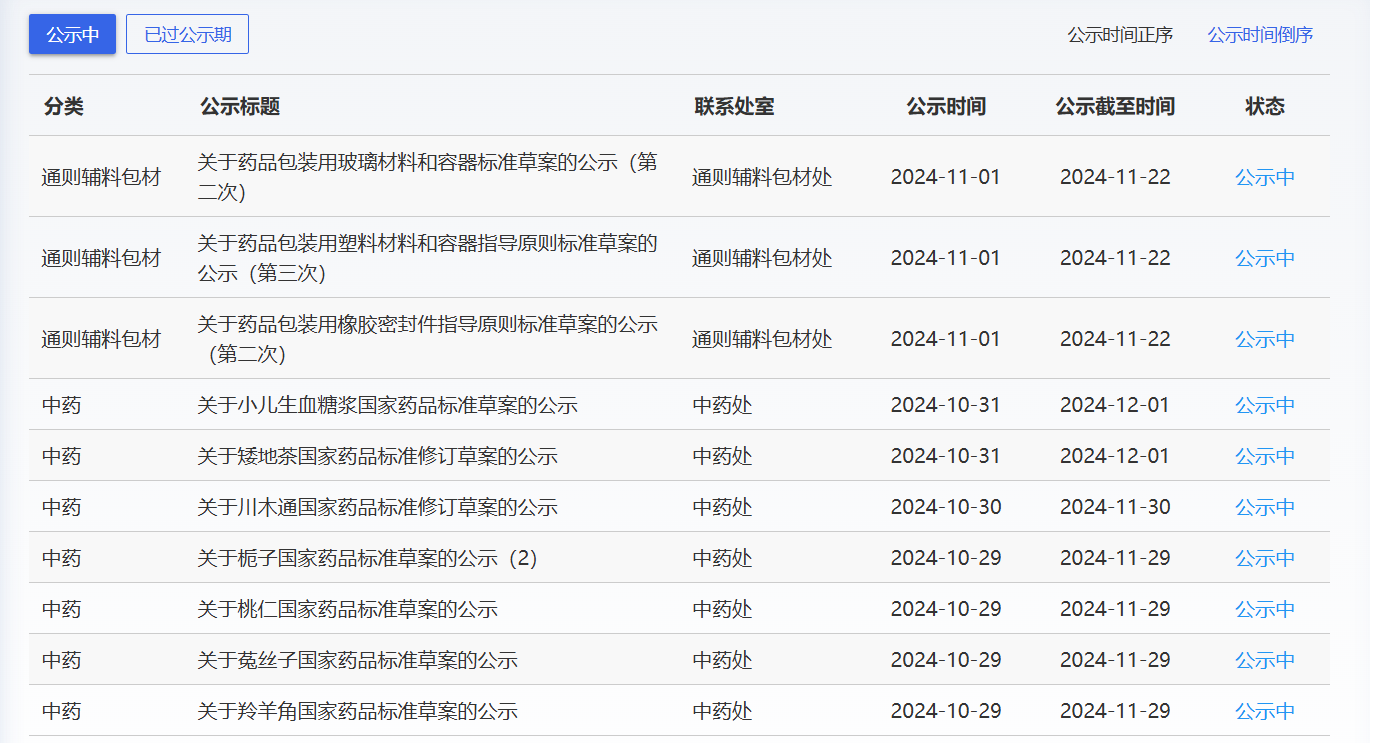
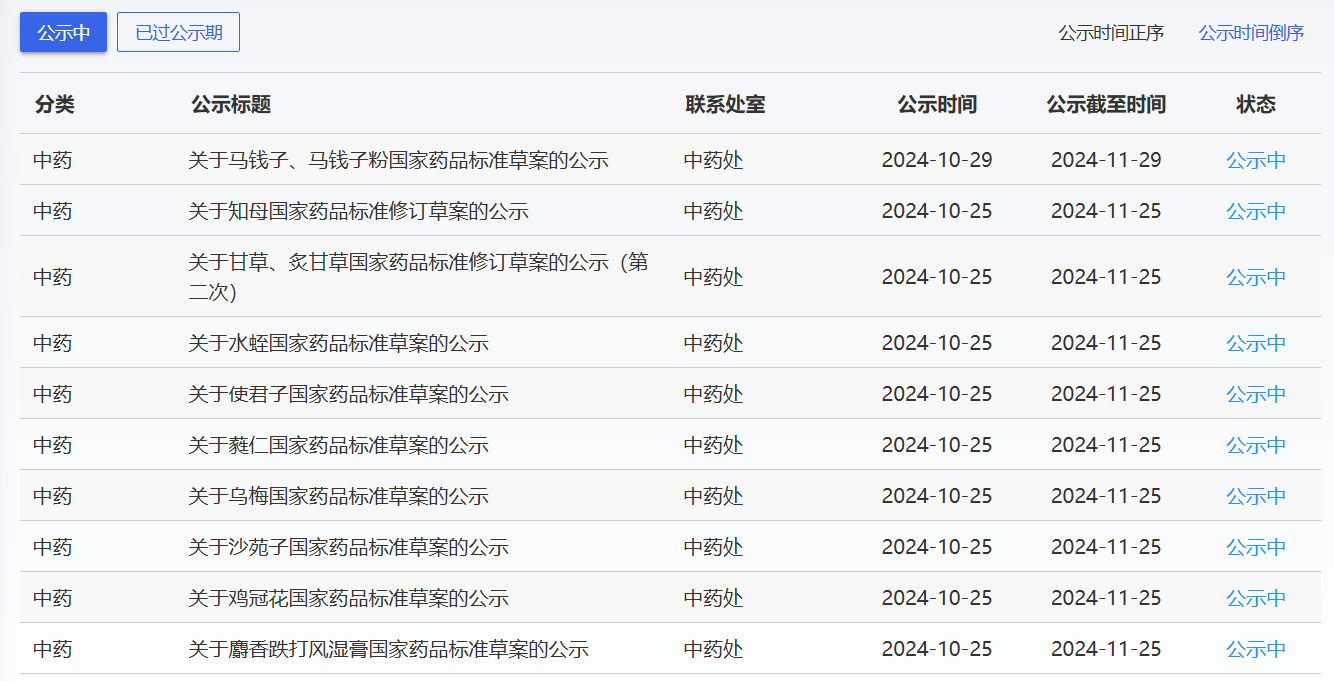
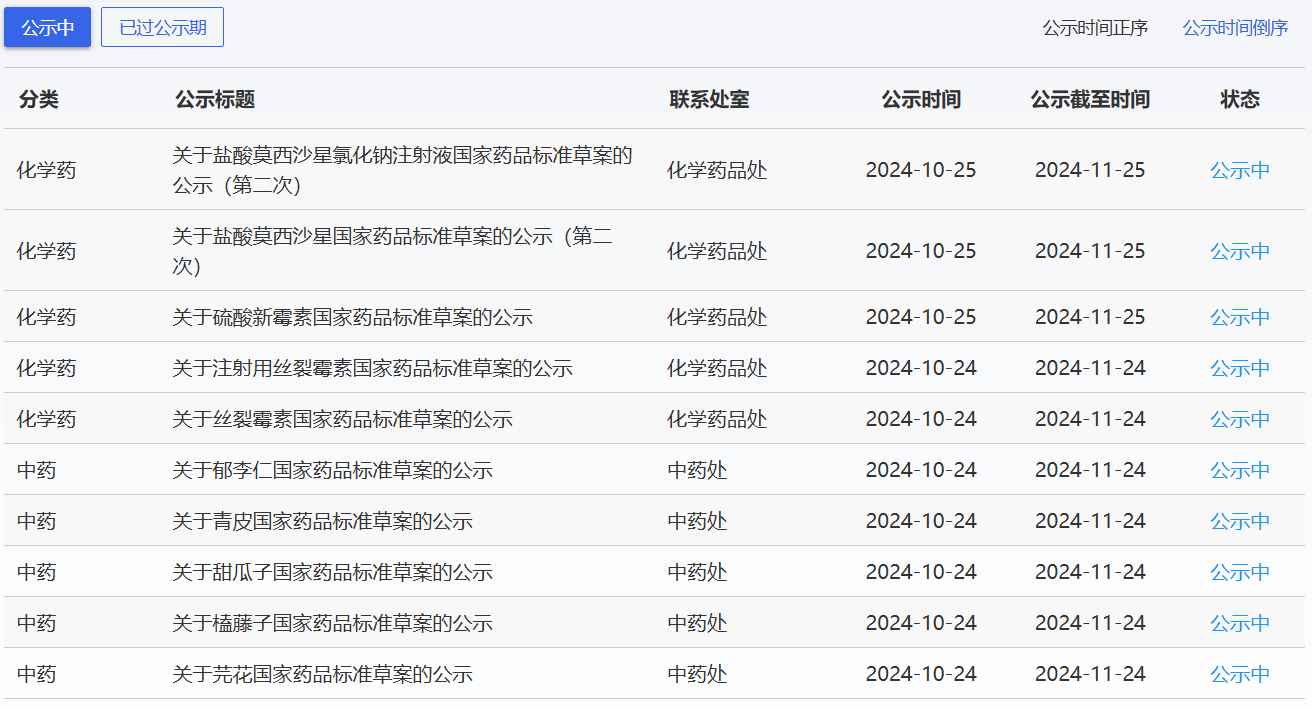
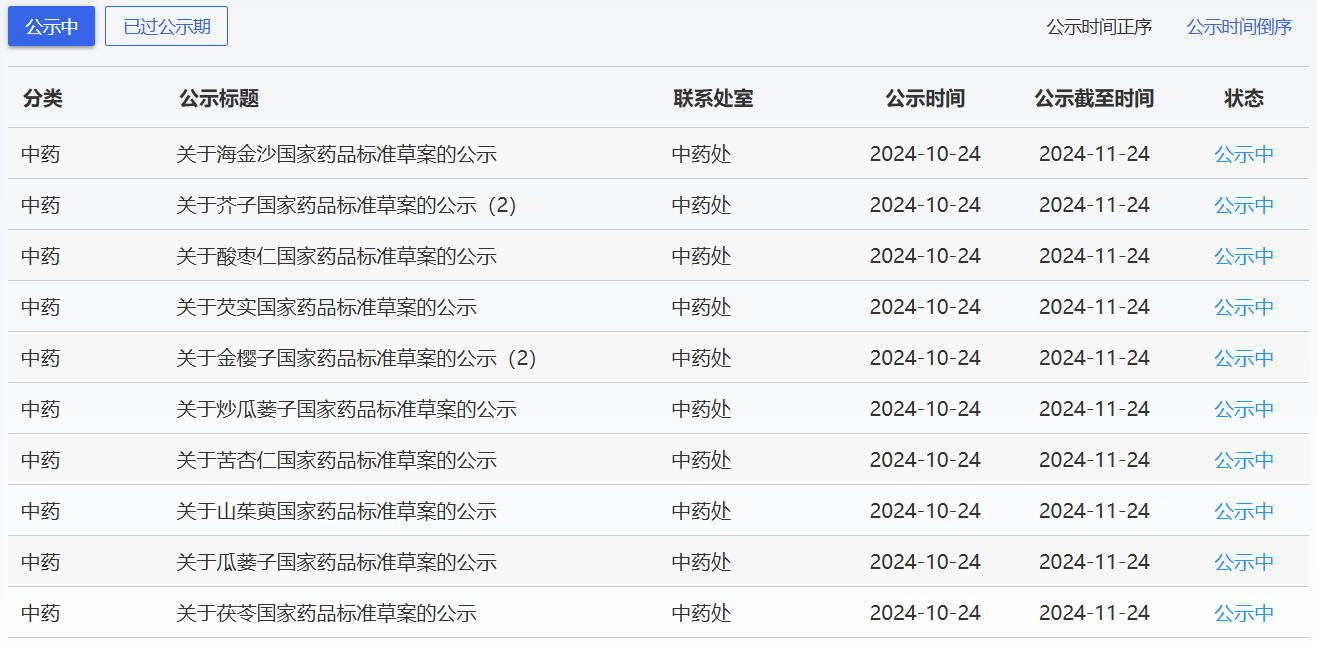
近期,藥典委發(fā)布的標準草案公示如下:


-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應在授權(quán)范圍內(nèi)使用,并注明“來源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場部:
技術(shù)市場部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
